Modelación de patógenos Una herramienta para la toma de decisiones sanitarias
Matías E. Gargiulo, Jaime R. Alarcón.Centro Tecnológico del Salmón, Cetecsal S.A.MGargiuloR@cetecsal.clepassalacquw@vitapro.cl
Introducción
El uso de herramientas oceanográficas para la toma de decisiones sanitarias en la salmonicultura es ampliamente utilizado en países como Canadá (Foreman y col., 2015 costa Oeste y Chang et al. 2007, costa Este), Noruega (Asplin y col., 2011), Escocia (Adams y col., 2013) e Irlanda (Navas y col., 2011). En estos países, los modelos han sido utilizados para entregar estimaciones de la conectividad entre centros de cultivo en relación con el transporte de partículas activas y pasivas, así como del potencial efecto de los centros de cultivo sobre el medio ambiente. Estas estimaciones, a su vez, son utilizadas para la gestión sanitaria y ambiental de la industria, lo que en el caso de Canadá incluye, i) evaluación y selección de zonas aptas para el cultivo, y ii) definición y redefinición de la zonas de manejo de acuicultura (Foreman y col., 2015), equivalentes a las Agrupaciones de Concesiones de Salmonicultura (ACS o barrios) chilenas.
En Chile, el desarrollo de este tipo de herramientas se encuentra limitado a contadas iniciativas académicas y privadas, y no son utilizadas aún por la autoridad para la toma de decisiones ambientales ni sanitarias.
El Centro Tecnológico del Salmón, Cetecsal, ha venido desarrollando en Chile, desde el año 2009, un modelo oceanográfico y de dispersión de partículas con propiedades biológicas, de características muy similares a los utilizados en Canadá y Noruega. Utilizando como punto de partida una serie de proyectos cofinanciados por Corfo (proyectos n° 09MCSS-6630 y 09MCSS-6612). Al igual que los modelos sanitarios desarrollados en Canadá, Noruega y otros países, el modelo sanitario desarrollado por Cetecsal consta de dos modelos:
1. Un modelo de la circulación oceánica de predicción retrospectiva (hindcasting) tridimensional. Modelo MIKE 3 FM.
2. Un modelo de seguimiento de partículas biológico a las que se entrega características de comportamiento (natación, hundimiento, flotación, etc.) y atributos tanto biológicos como químicos, que permiten simular progresiones de estadios de vida de distintos organismos o degradación de distintos compuestos. Este modelo utiliza las salidas del modelo de circulación oceánica para simular la dispersión y comportamiento de las partículas liberadas en lugares y tiempos específicos. (Modelo ECOLab).
Durante el proyecto Corfo n° 09MCSS- 6630, nuestro centro desarrolló y validó un modelo oceanográfico del Mar Interior de Chiloé, Región de Los Lagos, mediante el uso de MIKE 3 FM, sin embargo, no es el objeto del presente trabajo profundizar en la validación hidrodinámica. En el presente escrito, mostramos los avances realizados en el proceso de modelación del ciclo de vida del Caligus (Caligus rogercresseyi) mediante el modelo ECOLab y, posteriormente, la alimentación del modelo oceanográfico MIKE 3 del Mar Interior de Chiloé mediante este modelo del patógeno. También mostraremos el potencial de esta herramienta en la evaluación del riesgo sanitario, así como en la toma de decisiones y gestión sanitaria de los centros de cultivo, tal y como es utilizado en la mayoría de países salmonicultores (Escocia: Salama y col., 2013; Gillibrand y col., 2007 y Amundrud y col., 2009; Canadá: Stucchi y col., 2011; Noruega: Asplin y col., 2011).
Objetivos
1. Modelar el ciclo de vida libre del parásito C. rogercresseyi mediante el modelo ECOLab.
2. Modelar la emisión de Caligus desde distintos centros de cultivo mediante ECOLab
3. Modelar los procesos de dispersión de los distintos estadios de vida libre hasta llegar a la infestación de copepoditos.
4. Generar herramientas para la toma de decisiones sanitarias a partir de los modelos.
Métodos
El modelo de seguimiento de partículas biológico, ECOLab, tiene el potencial de modelar la progresión de estadios larvarios hasta llegar a C. rogercresseyi adultos. También es posible modelar el efecto de distintos parámetros físicos y químicos sobre cada estadio de vida, como son la temperatura y la salinidad o la adición de antiparasitarios. Por último, es posible asignar un comportamiento a cada estadio de vida por separado, es decir, capacidad de natación circadiana, vertical u horizontal, hundimiento o flotabilidad, etc. En la medida que la biología del organismo a modelar sea conocida, es posible, por lo tanto, agregar un considerable número de variables y complejidad al modelo.
Nuestro modelo biológico de C. rogercresseyi utiliza la literatura específica existente, donde se indican algunos de los parámetros físicos y químicos que afectan a cada uno de los estadios larvales de esta especie. Se incorporó la dinámica de la reproducción, desarrollo y mortalidad de C. rogercresseyi respecto a parámetros como temperatura y salinidad del ambiente (Bravo y col., 2008a, 2009b; González y Carvajal, 2003; González y col., 2012; Molinet y col., 2011; Bravo y Treasurer, 2011), parámetros que modulan las fluctuaciones estacionales.
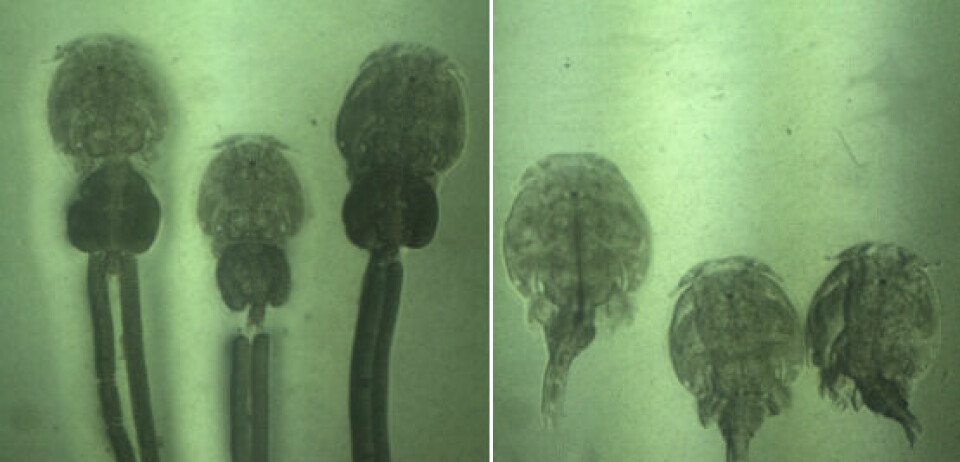
En relación con el ciclo de vida del Caligus, González y Carvajal (2003), clasifican el ciclo de vida de C. rogercresseyi en: fase de vida libre de propagación (Huevo, Nauplio I y II); fase de vida libre de infección (copepodito); y fase parasitaría (chalimus I, II, III, IV, juvenil, adulto) (Figura 1). Nuestro modelo simula las fases de propagación y de vida libre de infección, hasta llegar a la muerte de los copepoditos que no logren hospedero.
El modelo requiere, por lo tanto, ser alimentado con la información de conteo de hembras ovígeras a nivel de jaula de cada centro de cultivo.
Las condiciones ambientales que modulan la reproducción, desarrollo y mortalidad, se generan con el modelo oceanográfico MIKE 3, que considera velocidad y dirección de las corrientes, temperatura de la columna de agua y salinidad, con variabilidad tridimensional; es decir, presenta variabilidad horizontal y vertical. Lo que, además, está modulado por variables atmosféricas como: dirección y velocidad del viento, precipitación, temperatura del aire y radiación solar, entre otras.
El modelo de diseminación de SRS (Piscirickettsia salmonis) desarrollado por Cetecsal es una modificación y simplificación del modelo de Caligus, adaptado a la biología de este patógeno. En este caso, los parámetros relevantes incluidos en el modelo biológico son la intolerancia a agua dulce y el efecto de la temperatura en su supervivencia fuera del hospedero (Lannan & Fryer, 1994; Bravo & Campos, 1989; Cvitanich y col., 1990), así como el efecto precursor de SRS que tiene la presencia de Caligus (Boxshall y Bravo, 2000) Teniendo en cuenta que la transmisión horizontal a través del agua es con mayor probabilidad el principal vector de contagio entre centros de cultivo (Cvitanich y col., 1991; Almendras y col., 1997; Smith y col., 1999), el modelo de SRS cobra enorme relevancia.
Resultados
A partir del conteo de hembras ovígeras (Ho) de Caligus de cada centro de cultivo y en función de la salinidad y temperatura, el modelo de Caligus genera la proporción de nauplios I eclosionados y su desarrollo a nauplio II hasta llegar la fase de copepodito, que corresponde a la fase infestiva (Figura 1). La supervivencia de cada fase en el modelo biológico (EcoLab) es dependiente de la salinidad y temperatura entregadas por el modelo físico, MIKE 3. El modelo libera un número de partículas proporcional al número de nauplios I liberados en cada centro, y estas partículas se desplazan en la columna de agua, pudiendo pasar por distintos centros de cultivo. Sin embargo, la interacción entre centros de cultivo únicamente es contabilizada cuando son los copepoditos los que arriban a un centro de cultivo, dado que únicamente estos generan riesgo sanitario.
La liberación de nauplios I se puede realizar simulando un evento específico (Figura 2) o de forma continua (Figura 3) para simular un ciclo productivo completo. En este último caso, el número de Ho irá variando dependiendo de los conteos de Caligus informados por cada centro de cultivo. El área de modelación puede incluir un barrio, o varios barrios o macrozonas.
A partir del conteo de copepoditos que llegan a cada centro de cultivo en un tiempo determinado, se establecen dos tipos de estadísticos de gran utilidad para la gestión sanitaria: i) la matriz de interacción entre centros de cultivo (Tabla 1) basada en los tiempos de arribo de los copepoditos y los centros de cultivo donde éstos se originaron, y ii) el índice o nivel de riesgo sanitario acumulado (Figura 4), el que consiste en un índice absoluto o porcentual del número total de copepoditos acumulados en cada centro de cultivo en un tiempo determinado (semanal, mensual, etc.) Este índice permite comparar el riesgo relativo de cada centro de cultivo respecto de los demás centros del barrio o zona modelada, y permite también conocer la contribución de cada centro del barrio sobre el índice de riesgo obtenido en uno o más centros a elección.
A partir de la matriz de interacción, es posible obtener a su vez una estimación del orden en que los centros debieran realizar su tratamiento antiparasitario. Un sistema de tratamiento coordinado de esta manera permitirá que los centros “aguas arriba” realicen su tratamiento antes que los centros “aguas abajo”, coordinándolos de forma secuencial o en paralelo. Es importante, sin embargo, tener en cuenta que la interacción entre centros es un proceso muy dinámico y que, por lo tanto, la matriz de interacción también estará cambiando día a día, en función de los múltiples factores que afectan a la dirección y velocidad de las corrientes. Las matrices de interacción, por lo tanto, no son estáticas, y debieran actualizarse permanentemente en función de la evolución de las condiciones oceanográficas, ambientales y sanitarias de los centros modelados. En definitiva, es necesario contar con una modelación de interacción entre concesiones en distintos escenarios climáticos y mareales, con el fin de obtener un mapa más realista de las áreas de influencia de cada centro, el que debe abarcar el mayor número posible de los escenarios climáticos y oceanográficos locales (Foreman y col., 2015)
El modelo también nos permite a su vez conocer las zonas geográficas con mayor tendencia a la acumulación de partículas (zonas sumidero) así como los centros con mayor potencial de dispersión de partículas (centros diseminadores o “superspreaders”) (Figura 5) información que también es integrada a la hora de generar estrategias de tratamiento coordinado entre centros de cultivo.
El análisis de potenciales zonas de exclusión sanitaria así como revisión de los límites entre barrios, también se realiza a partir de la modelación de interacción entre centros y análisis de riesgo sanitario.
El índice de riesgo sanitario permite generar un sistema de alerta temprana, el que permitirá a su vez tomar medidas de acción preventiva. Cetecsal cuenta con un índice ya desarrollado y en proceso de mejora continua, que integra la condición sanitaria de cada uno de los centros de cultivo del área modelada, incluyendo no sólo Caligus, uno de los principales precursores de otras enfermedades, sino también mortalidad asociada con SRS. Este índice permite abordar la problemática de la alerta temprana en SRS, donde la efectividad de los tratamientos es altamente dependiente de que éstos sean suministrados en una etapa muy temprana del desarrollo de la enfermedad (Intesal, comunicación directa). El índice de riesgo y sistema de alerta temprana ha superado ya la etapa de prototipo y es entregado como servicio por la empresa Vitapro Chile (Salmofood).
Conclusiones
La generación de un modelo sanitario dependió en primer lugar del desarrollo y validación de un modelo oceanográfico confiable, necesario para que la dispersión de partículas “biológicas” ocurriera de forma lo más similar posible con la realidad. El siguiente prerrequisito fue contar con información biológica suficiente del organismo a modelar, así como de información sanitaria actualizada de los centros de cultivo involucrados en la modelación. Cabe destacar también la importancia de contar con un software que permitiera la modelación biológica acoplada con la modelación oceanográfica.
El siguiente desafío fue el desarrollo de funciones que traduzcan los resultados del modelo en herramientas de aplicación directa para la industria y que, por lo tanto, permitan que la toma de decisiones y la gestión sanitaria tengan lugar. Entre estas herramientas de uso directo, algunas de las más importantes descritas en este trabajo:
I. Matrices de interacción entre centros de cultivo.
II. Estrategias de tratamiento coordinado entre centros de cultivo.
III. Índice de riesgo sanitario y alertas tempranas para Caligus y SRS.
De esta manera se pretende mejorar la situación sanitaria de la industria salmonicultora, anticipando eficazmente el estado sanitario de un sector, mejorando la oportunidad y estrategia de sus tratamientos farmacológicos y/o parasitarios.
Una respuesta anticipada hace la diferencia entre el éxito y el fracaso de las acciones preventivas en los centros de cultivo, mejorando la rentabilidad de los productores de salmón.
Es importante destacar que las condiciones oceanográficas en la Región de Los Lagos varían en un amplio rango de escalas de tiempo, producto de la variabilidad tanto atmosférica como de corrientes marinas. Esto impactará no sólo en la variabilidad de las corrientes sino también en la salinidad y temperatura, lo que se verá reflejado en la supervivencia y distribución de los Caligus. Por lo tanto, encontramos muy diversos escenarios de interacción entre centros de cultivo, dependiendo del día y hora del año en que hagamos la simulación. Por último, es importante mencionar que se requiere una revisión periódica de la ubicación y extensión de los barrios, macrozonas, corredores sanitarios, zonas sumidero, etc., mediante este tipo de herramientas, con el fin de actualizar las actuales regulaciones sanitarias y ambientales.
Referencias
Almendras F.E., Fuentealba I.C., Jones S.R.M., Markham F.& Spangler E. (1997) Experimental infection and horizontal transmission of Piscirickettsia salmonis in freshwater-raised Atlantic salmon, Salmo salar L. Journal of Fish Diseases 20, 409–418.
Amundrud TL and Murray AG 2009. Modelling sea lice dispersion under varying envoronmental forcing in a Scottish sea loch. J Fish Dis 32: pp. 27-44.
Asplin, L., Boxaspen, K.K., and Sandvik, A.D. 2011. Modelling the distribution and abundance of planktonic larval stages of Lepeophtheirus salmonis in Norway. In Salmon Lice: An integrated approach to understanding parasite abundance and distribution. Edited by S. Jones and R.J. Beamish. Wiley-Blackwell, Oxford. pp 31-50. (Accessed November, 2014)
Bravo S and Treasurer JW 2011. The spatial distribution patterns of Caligus rogercresseyi and C. elongatus on Atlantic salmon hosts (Salmo salar). Aquaculture 320: pp. 154-158.
Bravo S, Erranz F and Lagos C 2009. A comparison of se lice, Caligus rogercresseyi, fecundity in four areas in southern Chile. J Fish Dis 32: pp. 107-113.
Bravo S, Pozo V and Silva MT 2008. The tolerance of Caligus rogercresseyi to salinity reduced in southern Chile. Bull. Eur. Ass. Fish Pathol. 28(5): pp. 198.
Bravo S 2003. Sea lice in Chilean salmon farms. Bull. Eur. Ass. Fish Pathol. 23: pp. 197-200.
Bravo S. & Campos M. 1989. Coho salmon syndrome in Chile. American Fisheries Society Newsletter 17, 3.
Chang, B.D., Page F.H., Losier R.J., Lawton P., Singh, R., and Greenberg, D.A. 2007.
Evaluation of bay management area scenarios for the southwestern New Brunswick salmon aquaculture industry. Aquaculture Collaborative Research and Development Program final project report. Can. Tech. Rep. Fish. Aquat. Sci. 2722: 1-69.
Cvitanich J., Garate O. & Smith C.E. (1990) Etiological agent in a Chilean coho disease isolated and confirmed by Koch’s postulates. American Fisheries Society Newsletter 18, 1–2.
Cvitanich J., Garate O. & Smith C.E. (1991) The isolation of a rickettsia-like organism causing disease and mortality in Chilean salmonids and its confirmation by Koch‘s postulate. Journal of Fish Diseases 14, 121–145.
Foreman, M.G.G., Chandler, P.C., Stucchi, D.J., Garver, K.A., Guo, M., Morrison, J., Tuele, D. 2015. The ability of hydrodynamic models to inform decisions on the siting and management of aquaculture facilities in British Columbia. DFO Can. Sci. Advis. Sec. Res. Doc. 2015/005. vii + 49 p.
Foreman, M.G.G., P. Czajko, P., Stucchi, D.J., and Guo, M. 2009. A finite volume model simulation for the Broughton Archipelago, Canada. Ocean Model. 30:29-47. (Accessed November 17, 2014)
Gillibrand P. and Willis K., 2007. Dispersal of sea louse larvae from salmon farms: modelling the influence of environmental conditions and larval behaviour. Aquatic Biology 1: pp. 63-85.
González, M. and Carvajal, J. 2003. Life cycle of Caligus rogercresseyi (Copepoda: Caligidae) parasite of Chilean reared salmonids. Aquaculture 220: pp. 101-117.
González M, Molinet C, Arenas B, Asencio G and Carvajal J 2012. Fecundity of the sea louse Caligus rogercresseyi on its native host Eleginops maclovinus captured near salmon farms in southern Chile. Aquaculture Research 43: pp. 853- 860.
Lannan C. & Fryer J. (1994) Extracellular survival of Piscirickettsia salmonis. Journal of Fish Diseases 17, 545–548.
Molinet C, Cáceres M, Gonzalez M, Carvajal J, Asencio G, Díaz M, Díaz P, Castro M and Codjambassis J 2011. Population dynamic of early stages of Caligus rogercresseyi in an embayment used for intensive salmon farms in Chilean inland seas. Aquaculture 312: pp. 62-71.
Navas, J.M., Telfer, T.C., and L.G. Ross, L.G. 2011. Application of 3D hydrodynamic and particle tracking models for better environmental management of finfish culture. Cont. Shelf Res. 31: 675-684. (Accessed November 17, 2014)
Salama, N.K.G., Collins, C.M., Fraser, J.G., Dunn, J., Pert, C.C., Murray, A.G., and Rabe, B. 2013. Development and assessment of a biophysical dispersal model for sea lice. J. Fish. Dis. 36: 323?337. (Accessed November 17, 2014)
Smith P.A., Pizarro P., Ojeda P., Contreras J., Oyanedel S. & Larenas J. (1999) Routes of entry of Piscirickettsia salmonis in rainbow trout Oncorhynchus mykiss. Diseases of Aquatic Organisms 37, 165–172.
Stucchi D, Guo M, Foreman M, Czajko P, Galbraith M, Mackas D and Gillibrand P 2011. Modelling sea lice production and concentrations in Broughton Archipielago, British Columbia. Salmon Lice: An integrated Approach to Understanding Parasite Abundance and Distribution, (ed. By S. Jones & R. Beamish), pp. 117-150 . Willey-Blackwell, Oxford.