El sistema inmunológico olfativo de los salmónidos y el potencial de las vacunas nasales en salmonicultura
Dra. Irene Salinas Universidad de Nuevo México Departamento de Biología Albuquerque, Nuevo México, USA Teléfono: +1 5052770039 Email: isalinas@unm.edu
Introducción El olfato es uno de los sentidos claves presente en todos los animales. Mientras que en animales terrestres las señales químicas son volátiles, en animales acuáticos, las señales químicas están disueltas en el agua. Sin embargo, la anatomía del sistema olfativo aparece conservada en todos los vertebrados. Los peces tienen una o dos parejas de "narinas" (u orificios nasales) por los que el agua entra en la cavidad nasal (Figura 1). A través de la natación, los peces dirigen un constante flujo de agua hacia sus narinas situadas en la parte anterior de la cabeza. La mayoría de las especies de peces tienen receptores olfativos muy sensibles, capaces de detectar la presencia de moléculas (olores) en concentraciones muy bajas. Dentro de la cavidad nasal se encuentra el epitelio olfativo formando una roseta (Figura 1). Esta roseta consiste en un epitelio neuroolfatorio compuesto por tres tipos diferentes de neuronas sensoriales que detectan moléculas disueltas en el agua. Estas neuronas son ciliadas, microvellosas o tipo cripta (Hansen y Zeiske, 1998; Hansen y Zielinski, 2005). En pez cebra, además, un cuarto tipo de neurona olfativa acaba de ser descrita, las neuronas kappe (Ahuje y col., 2014). El epitelio olfativo está conectado con el sistema nervioso por el lóbulo olfativo y por abundantes capilares a la circulación sistémica.
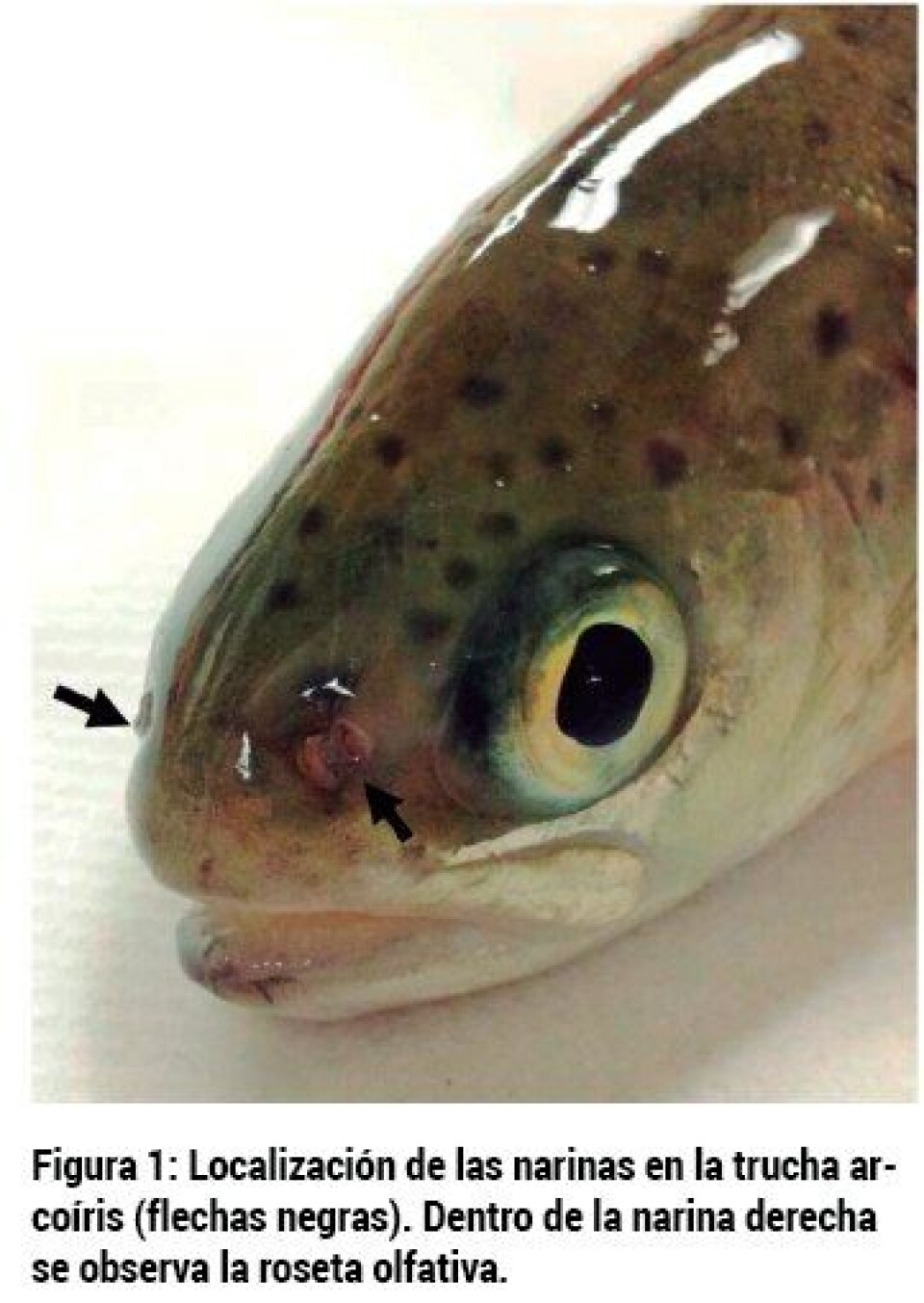
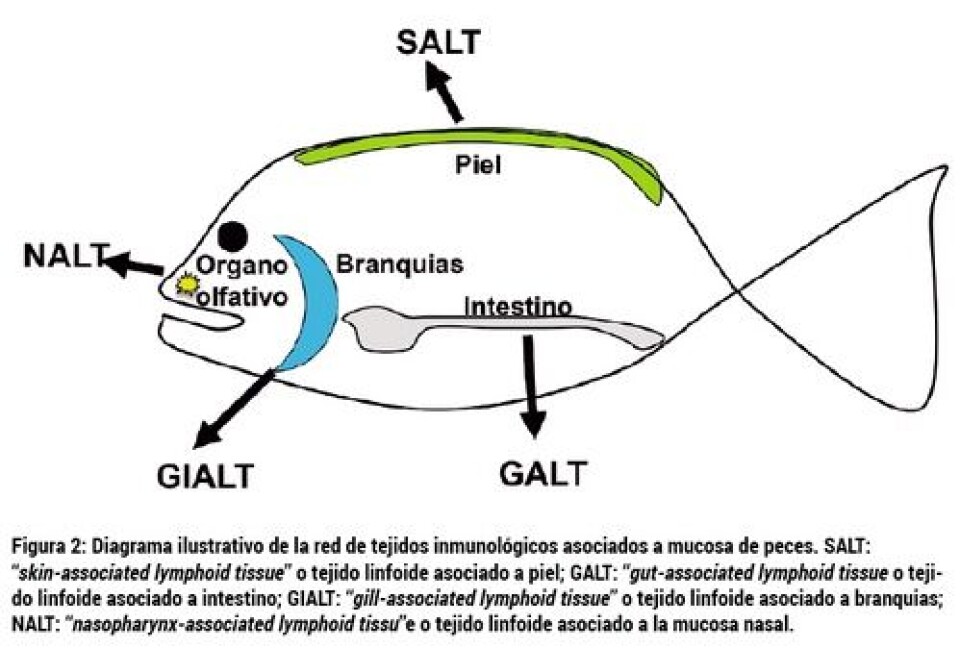
Durante siglos hemos sabido que los humanos y otros animales terrestres responden a patógenos volátiles a través del sistema inmunológico nasal, también llamado NALT (“nasopharynx-associated lymphoid tissue”). Sin embargo, NALT siempre ha sido considerado un modo de defensa contra patógenos inhalados. En nuestro laboratorio, nos preguntamos si este sistema está conservado en vertebrados acuáticos como salmónidos u otros peces. Esta hipótesis se basa en el hecho de que los patógenos disueltos en el agua alcanzan las superficies nasales de los peces constantemente, de igual manera que los virus como el de la gripe alcanzan las mucosas nasales de los humanos. La existencia de este sistema inmunológico (NALT) es la que permite el uso de la nariz como una ruta de administración de vacunas. Las vacunas nasales o intranasales son vacunas mucosas y pueden ser líquidas o en forma de aerosol. En cualquier caso, su administración es muy simple y segura ya que no necesita ninguna aguja, sólo rociar la fosa nasal con la vacuna. Un ejemplo de vacuna nasal comercial es FluMist, un aerosol contra el virus de la gripe para uso en humanos (https://www.flumistquadrivalent.com/consumer/index.html). La vacunación es la forma más efectiva de control de enfermedades infecciosas en salmonicultura. Durante los últimos 30 años, millones de peces de cultivo se han vacunado contra enfermedades bacterianas y virales en todo el mundo. Los tres métodos de vacunación actualmente comercializados son la inyección, la inmersión o baño y las vacunas orales añadidas al alimento. La inmersión y la ruta oral son las únicas dos rutas que estimulan las superficies mucosas por donde los patógenos penetran al pez. Sin embargo, su efectividad es menor si la comparamos con las vacunas inyectadas (Plant y LaPatra, 2011). Hace sólo unos meses, estudios pioneros en mi laboratorio demostraron que los salmónidos poseen un sistema inmunológico innato y adaptativo asociado al órgano olfativo (Tacchi y col., 2014). Esto significa que NALT es parte de la red del sistema inmunológico de mucosas (MALT, “mucosa-associated lymphoid tissue”) de los peces (Figura 2). Este descubrimiento llevó a realizar los primeros estudios piloto pertinentes a vacunas nasales para uso en acuicultura. Tal y como se explica aquí, las vacunas nasales son muy fáciles de administrar en peces y parecen estimular muy eficazmente tanto las superficies mucosas como la inmunidad sistémica (Tacchi y col., 2014). Esto se debe a una importante cualidad del sistema olfativo de los vertebrados, su profusa irrigación por el sistema circulatorio.
Metodología Utilizando la trucha arcoíris (Oncorhynchus mykiss) como modelo, realizamos una caracterización de la estructura (histología), composición celular (tinciones con anticuerpos contra linfocitos B) y composición molecular (qPCR y microarray) del NALT en condiciones control y tras la inmunización con vacunas. Dada la preponderancia de linfocitos IgT+ en todos los MALT de trucha (Zhang y col., 2010), realizamos tinciones con anticuerpos monoclonales anti-IgT y anti-IgM en suspensiones de células de NALT de truchas control. Para ello tuvimos primero que desarrollar la metodología para el aislamiento de dichas células, lo cual se hizo modificando los protocolos previamente desarrollados para intestino (Zhang y col., 2010). Las suspensiones celulares teñidas de esta manera se analizaron por citometría de flujo tal y como se explica en Tacchi y col., 2014. También recogimos secreciones (“moco”) nasales de truchas control para poder evaluar si los anticuerpos IgM e IgT son secretados o no al medio externo. Las muestras de moco se analizaron por Western blot utilizando los mismos anticuerpos monoclonales. A continuación nos propusimos analizar si las truchas tienen una comunidad de bacterias comensales igual que las que se encuentran en la piel, branquias e intestino. Para ello realizamos hibridaciones in situ de fluorescencia así como tinciones de bacterias aisladas que se observaron bajo el microscopio de fluorescencia. La cinética de la respuesta inmunológica nasal se caracterizó usando PCR cuantitativa en muestras de tejido nasal obtenidas 1 día, 4 días, 7 días, 21 días y 28 días después de vacunar truchas con la vacuna atenuada contra el virus de la Necrosis Hematopoyética Infecciosa (IHNv). Los resultados del estudio cinético sirvieron para seleccionar los tiempos adecuados de muestreo y realizar estudios moleculares más completos utilizando miroarrays específicos para trucha (Agilent). Como modelos de vacunación seleccionamos dos tipos de vacunas, la vacuna vírica viva atenuada contra IHN y una vacuna muerta contra Yersiniosis. Ambas vacunas se administraron nasalmente o por alguna de las rutas de vacunación ya establecidas, como la inyección, a modo de comparación. La eficacia de la protección se midió retando los peces vacunados o no vacunados (control) con los patógenos respectivos (IHNv o Yersinia ruckeri).
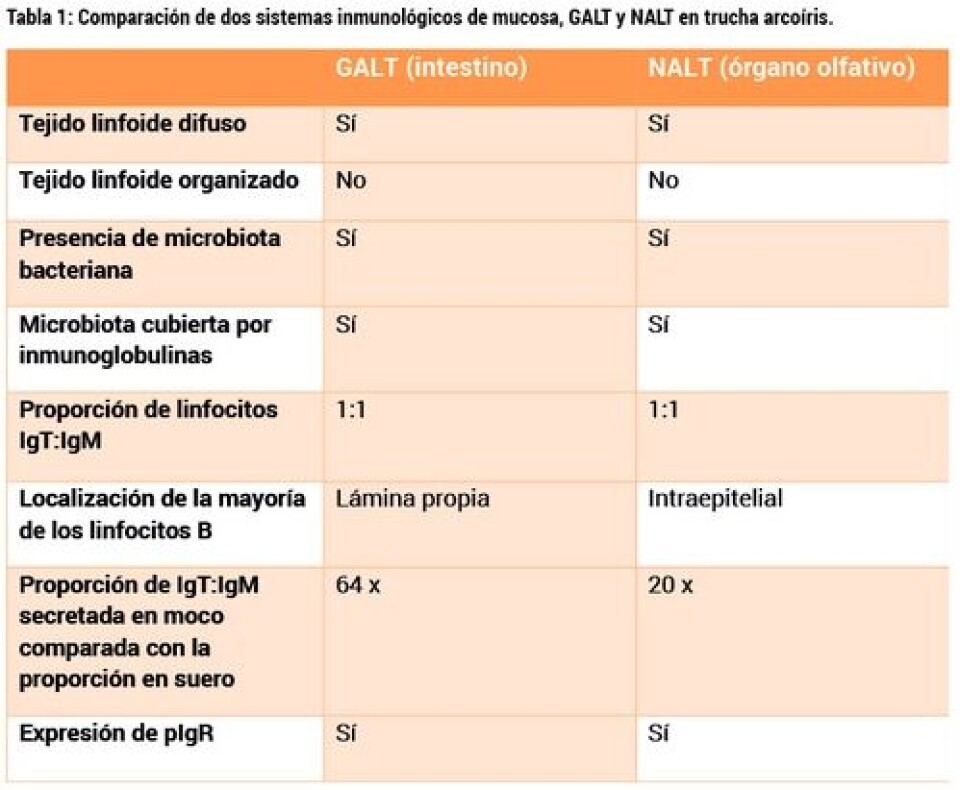
Resultados Los estudios histológicos, celulares y moleculares demuestran que el NALT de trucha se parece en grandes rasgos a los otros tres MALT previamente descritos en peces teleósteos. Estas características quedan resumidas en la Tabla 1, que compara el NALT y el GALT (“gut-associated lymphoid tissue” o sistema inmunológico intestinal) de la trucha arcoíris. Específicamente, el NALT de salmónidos consiste en una red difusa de leucocitos que no forman ninguna estructura organizada como las que se hallan en endotermos. La mayoría de los linfocitos en el NALT de trucha, sin embargo, se encuentran distribuidos intrapitelialmente y no en la lámina propia, a diferencia del intestino. A nivel de la distribución de linfocitos B, la proporción de linfocitos IgM e IgT es similar a la de piel e intestino, con un porcentaje aproximado del 50% de cada una de las dos poblaciones. En moco nasal, los ensayos de Western Blot revelaron que el ratio IgT/IgM secretadas es mucho mayor que en plasma (unas 20 veces mayor), otro de los rasgos que caracteriza los MALT de peces (Zhang y col., 2010; Tacchi y col., 2014). A nivel molecular es muy interesante que en peces control, el sistema olfativo expresa la mayoría de los marcadores del sistema inmunitario a niveles casi tan elevados como el riñón cefálico. Los resultados de hibridación in situ demostraron claramente la presencia de una comunidad bacteriana abundante que vive en asociación con la superficie mucosa nasal de trucha. La composición y diversidad de esta comunidad bacteriana acaba de ser determinada en nuestro laboratorio (manuscrito en revisión). Cuando se aislaron las bacterias y se tiñeron con anticuerpos para ver si estaban cubiertas de inmunoglobulinas, se vio claramente que las bacterias nasales aparecían cubiertas por las inmunoglobulinas secretadas presentes en el moco nasal de la trucha. La mayoría de las bacterias están cubiertas por IgM, IgT o ambos tipos de anticuerpos. El uso de una plataforma de microarray con 44000 genes impresos nos permitió evaluar los eventos moleculares que suceden en el órgano olfativo de la trucha una vez se le administra nasalmente la vacuna viva contra IHN. La mayoría de la respuesta innata se concentra en el día 4 tras la vacunación mientras que los genes de la inmunidad adaptiva aparecen mayormente modificados al día 14 (Tacchi y col., 2014). Usando esta plataforma conseguimos identificar las moléculas clave involucradas en la respuesta antiviral del sistema inmunológico nasal. Entre ellas se encuentra el receptor polimérico de inmunoglobulinas (pIgR), el marcador de respuestas de interferon tipo I (Mx), varias quimioquinas y citoquinas y el factor transcripcional ID2. Para un listado completo de los genes modificados por la vacuna IHNv en el órgano olfativo de trucha refiéranse al artículo Tacchi y col., 2014. La histología del órgano olfativo a los distintos tiempos de muestreo tras la vacunación nasal refleja claramente los eventos moleculares encontrados en el estudio por microarray. Por ejemplo, 4 días tras la vacunación, se puede observar una gran expansión de la lámina propia del epitelio neuroolfativo, un aumento en el número de capilares y una gran infiltración de leucocitos (tanto macrófagos como linfocitos) en esa misma zona. Estos cambios histológicos remiten con el tiempo y dejan de ser aparentes 28 días tras la vacunación (Tacchi y col., 2014). Los estudios pertinentes a la eficacia de las vacunas nasales y su comparación con la ruta de inyección fueron muy claros. Las vacunas intranasales son al menos tan eficaces como las vacunas inyectadas en ambos modelos (IHNv y Yersiniosis). La eficacia fue de más del 95% en todos los estudios tanto 7 días como 28 días tras la vacunación. Los niveles más altos de protección (100%) se observaron cuando los peces se retaron 7 días tras la vacunación con IHNv (Tacchi y col., 2014).
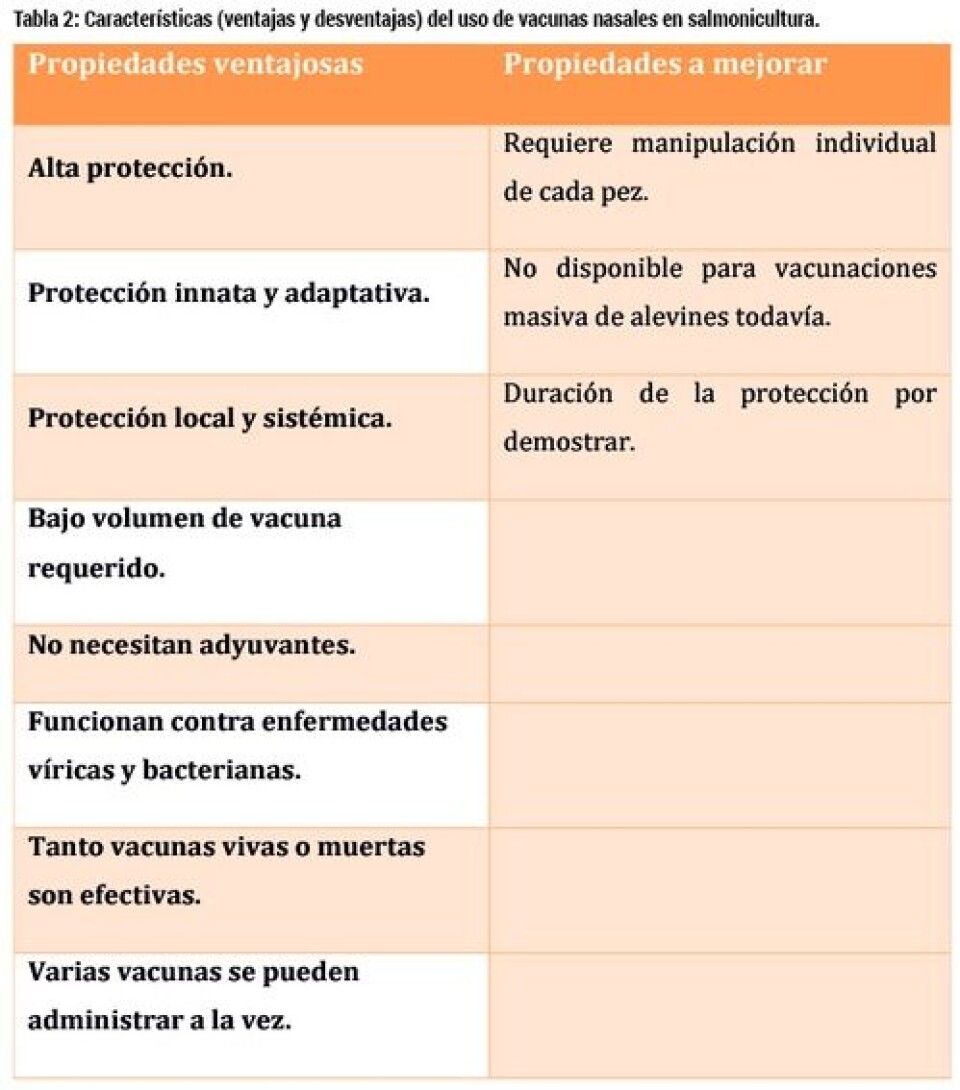
Alcance del estudio y conclusiones El descubrimiento de NALT en salmónidos, y su probable presencia en todos los peces teleósteos, abre un nuevo campo en la vacunación de peces. Las vacunas nasales se incorporan, por lo tanto, a la lista de vacunaciones mucosas aplicables en acuicultura. Las características, ventajas y desventajas del uso de estas vacunas se encuentran resumidas en la Tabla 2. Es importante resaltar que las vacunas nasales estudiadas generan unos niveles de protección extremadamente elevados incluso sin el uso de adyuvantes. En otras especies, ciertas formulaciones requieren el uso de adyuvantes nasales que aseguren la incorporación adecuada del antígeno a través del epitelio nasal. Por ello, en caso de encontrar formulaciones para peces que no sean efectivas por sí solas, sería posible mejorar su empleo con el uso de adyuvantes específicos. Hasta ahora, todos nuestros estudios se han realizado en trucha arcoíris, pero en el verano del 2015 comenzarán estudios piloto de larga duración (12 meses) en centros de cultivo de salmón Atlántico en Noruega. Estos estudios son necesarios a la hora de establecer la especificidad y duración de la protección inducida por las vacunas nasales. Es importante resaltar que tanto las vacunas vivas atenuadas como muertas y tanto vacunas virales como bacterianas pueden ser administradas por la ruta nasal. Uno de los avances más importantes para la acuicultura es nuestro estudio reciente que demuestra una gran protección contra IHNv y Yersiniosis cuando ambas vacunas son administradas a la vez en un mismo animal, cada vacuna en una narina distinta (LaPatra y col., 2015). Hasta el momento, el protocolo de vacunación nasal requiere anestesia y la manipulación individual de peces, de manera similar al protocolo de inyección. Esperamos que a través de colaboraciones con la industria, podamos desarrollar nuevas tecnologías que permitan la vacunación masiva de larvas de salmónidos con mínima manipulación. Asimismo, esperamos expandir las aplicaciones de estas vacunas a todo tipo de especies de cultivo, tanto de agua dulce como de agua salada. El objetivo de nuestro trabajo es continuar apostando por las vacunas nasales para peces y así lograr traducir la investigación inmunológica de nuestro laboratorio en productos comerciales que se unan a la gama de productos usados rutinariamente en instalaciones acuícolas de todo el mundo y obtener el control de un gran número de patógenos.
Referencias Ahuja G, Bozorg Nia S, Zapilko V, Shiriagin V, Kowatschew D, Oka Y, Korsching SI. Kappe neurons, a novel population of olfactory sensory neurons. Science Scientific Reports 2013; 4, Article number: 4037. Hansen A, Zeiske E. The peripheral olfactory organ of the zebrafish, Danio rerio: An ultrastructural study. Chem Senses 1998; 23, 39–48. Hansen A, Zielinski, BS. Diversity in the olfactory epithelium of bony fishes: development, lamellar arrangement, sensory neuron cell types and transduction components. Journal of Neurocytology 2005; 34(3-5):183-208. LaPatra SE, Kao S, Erhardt EB, Salinas I. Evaluation of dual nasal delivery of infectious hematopoietic necrosis virus and enteric red mouth vaccines in rainbow trout (Oncorhynchus mykiss). Vaccine 2015; In press. Plant KP, LaPatra SE. Advances in fish vaccine delivery. Dev Comp Immunol. 2011;35(12):1256-62. Tacchi L, Musharrafieh R, Larragoite ET, Crossey K, Erhardt EB, Martin SA, LaPatra SE, Salinas I. Nasal immunity is an ancient arm of the mucosal immune system of vertebrates. Nat Commun. 2014; 5:5205. Zhang YA, Salinas I, Li J, Parra D, Bjork S, Xu Z, LaPatra SE, Bartholomew J, Sunyer JO. IgT, a primitive immunoglobulin class specialized in mucosal immunity. Nat Immunol. 2010;11(9):827-35.
















