Lecciones aprendidas a través de la epidemiología veterinaria El virus ISA, siete años después
Fernando O. Mardones1, 2, Pablo Valdes-Donoso, Andrés M. Pérez, Tim E Carpenter 1Instituto de Medicina Preventiva Veterinaria, Universidad Austral de Chile 2Center for Animal Disease Modeling and Surveillance (Cadms), University of California, Davis, USA
Pocas veces se han reportado epidemias causadas por agentes infecciosos, que afecten a un sistema de producción animal en forma tan severa, y una de esas, fue la epidemia del virus de la anemia infecciosa del salmón (ISA, por sus siglas en inglés) que generó la crisis sanitaria más importante en nuestra industria salmonicultora y país. Sin embargo, el reporte de epidemias trae consigo un lado positivo, y es que permiten comprender desde diferentes disciplinas los mecanismos más importantes en su origen, transmisión, dispersión y eventual eliminación. La serie de estudios reportados con respecto a la epidemia fue visualizada como una oportunidad única, que requiere aún más estudios, así como hoy existen innumerables casos de epidemias que actualmente continúan su estudio, pese a que han transcurrido diez, 30 o 100 años (Ster y col. 2012; Wright y col. 2013; Boender y col. 2014; Karlsson y col. 2014).
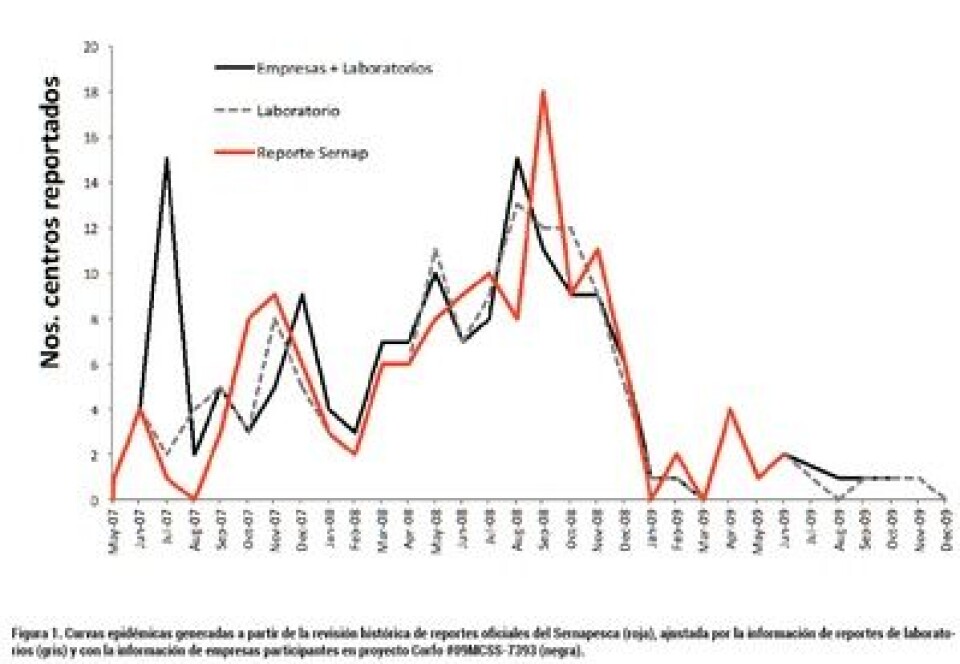
Este documento tiene por objeto integrar los resultados de más de tres años de investigaciones lideradas por el autor principal y llevadas a cabo en conjunto por un grupo de investigadores del “Center for Animal Disease Modeling and Surveillance (Cadms)” en la Universidad de California, Davis (UC Davis). Estas investigaciones fueron financiadas principalmente por el programa de formación de Capital Humano Avanzado de Becas Chile, Conicyt, sin embargo, a lo largo de su desarrollo se generaron múltiples colaboraciones y se obtuvieron nuevas formas de financiamiento. El primer año de la epidemia y la detección de clústeres espacio-temporales Oficialmente, el Servicio Agrícola y Ganadero (SAG) reportó a la Organización Mundial de Sanidad Animal (OIE) el primer caso de ISA en un centro de cultivo ubicado en la Isla Lemuy, el 8 de agosto del 2007 (Notificación inmediata Nro. 5890). Según este reporte, el inicio del brote fue el 15 de junio del 2007, experimentando elevadas mortalidades luego de brotes consecutivos de SRS, cuyos tratamientos fueron ineficaces (Godoy y col. 2008). La ubicación geográfica de este primer centro infectado tuvo consecuencias dramáticas, como era de esperarse para una enfermedad causada por un agente altamente infeccioso. Debido a que este centro estaba ubicado en una de las áreas más productivas y densas de la industria, la transmisión local a través del movimiento pasivo de aguas infectadas jugó un rol determinante, como se demostró con la detección de clústeres espacio-temporales (Mardones y col. 2009). Sin embargo, considerando las distancias marítimas entre los primeros seis casos reportados, fue muy probable que haya existido también una vía de transmisión mecánica a larga distancia que, por lo general, corresponde al contagio indirecto producto de movimientos de personas, peces, o materiales contaminados. Es muy probable que la dispersión inicial del virus ISA tuvo mecanismos de transmisión local y de larga distancia, muy similares a la epidemia de ISA descrita en Escocia, entre 1998 y 1999 (Murray y col. 2002). Como parte del proyecto Corfo-Innova 09MCSS-7393 ejecutado por el IFOP, se recolectó información confidencial de parte de representantes de la industria, quienes parcialmente entregaron la fecha más probable y temprana de la detección de ISA en sus centros de cultivo durante la epidemia. Una vez ajustada esta información, fue posible representar la curva epidémica más realista para ISA en Chile (Mardones y col. 2011). Este retraso tiene implicancias en el desarrollo de la curva epidémica, tal como muestra la siguiente Figura 1.
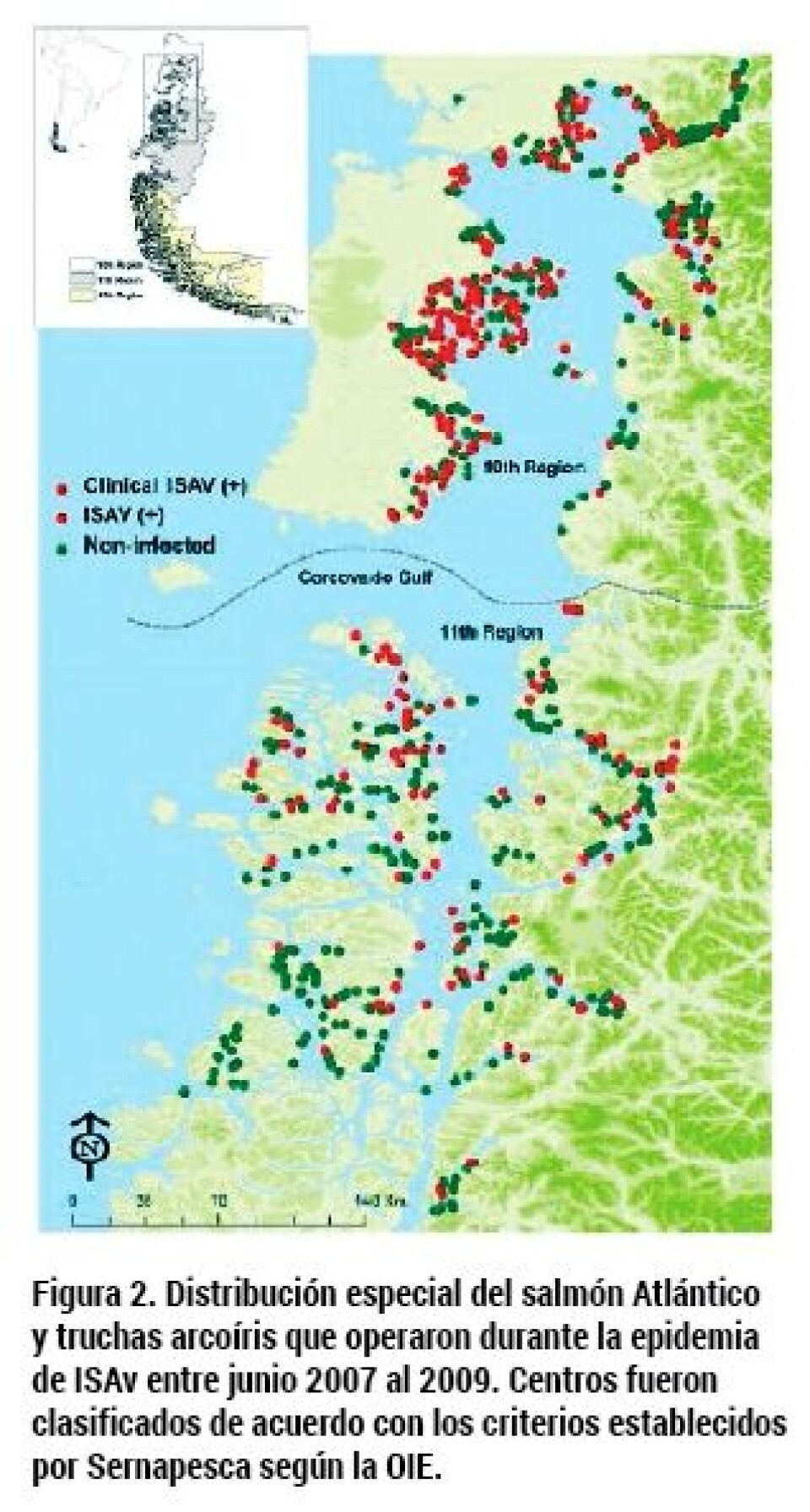
La información final utilizada para todos los análisis indicó que 152 y 91 centros en las regiones de Los Lagos y Aysén, respectivamente, reportaron infección por ISAv. Esto significó que la prevalencia para cada región fuera de 54,9% y 45%, respectivamente. Tasa de diseminación del virus ISA La tasa de diseminación del virus ISA en las regiones de Los Lagos y Aysén fueron estimadas indirectamente como el número básico de reproducción (Rf) a nivel de centros de cultivo (Mardones y col. 2011). El Rf es un parámetro esencial que determina el número más probable de infecciones que pueda generar un centro durante su estado de infecciosidad. En otras palabras, desde que los salmones en un centro se infectan hasta que son removidos de éste (periodo de infecciosidad), uno puede estimar el número de nuevas infecciones que causó dicho centro infectado inicialmente. De esta forma, el valor promedio de Rf varió entre 1,3 y 1,9, siendo este parámetro de mayor magnitud en la Región de Los Lagos que en Aysén. Sin embargo, la magnitud del Rf fue muy diferente en ambas regiones. En general, la magnitud del Rf en Los Lagos fue el doble que en Aysén. Adicionalmente, las distancias entre el primer centro de cultivo infectado y los secundarios para Los Lagos fueron sustancialmente menores comparadas con Aysén. Estos resultados sugieren que para cada región existieron mecanismos de transmisión muy distintos al principio de la epidemia. En Los Lagos, muchos centros habrían sido infectados en un periodo relativamente corto de tiempo, facilitado en parte por los siguientes factores: (1) el primer caso, y aquellos inmediatamente secundarios, correspondían a la misma empresa, donde además, cinco de los siete centros “súper-diseminadores” correspondían también a la misma; (2) las características de conexión en la región de Los Lagos eran mas agregadas que en Aysén, con una mayor proporción de puntos de mayor riesgo (plantas de proceso, plantas de cosecha, puertos mayores y menores, etc.); y (3) las distancias entre los centros fueron significativamente más cortas en Los Lagos, favoreciendo la transmisión local y pasiva por movimiento de aguas La dispersión inicial del virus ISA en la Región de Aysén fue más lenta que en la de Los Lagos. Posibles razones incluyen que el primer caso reportado ocurrió seis meses después del primer caso en la Isla Lemuy, cuando las medidas de cuarentena y otras estaban establecidas, y tanto veterinarios como técnicas de laboratorios estaban preparados para nuevos diagnósticos.
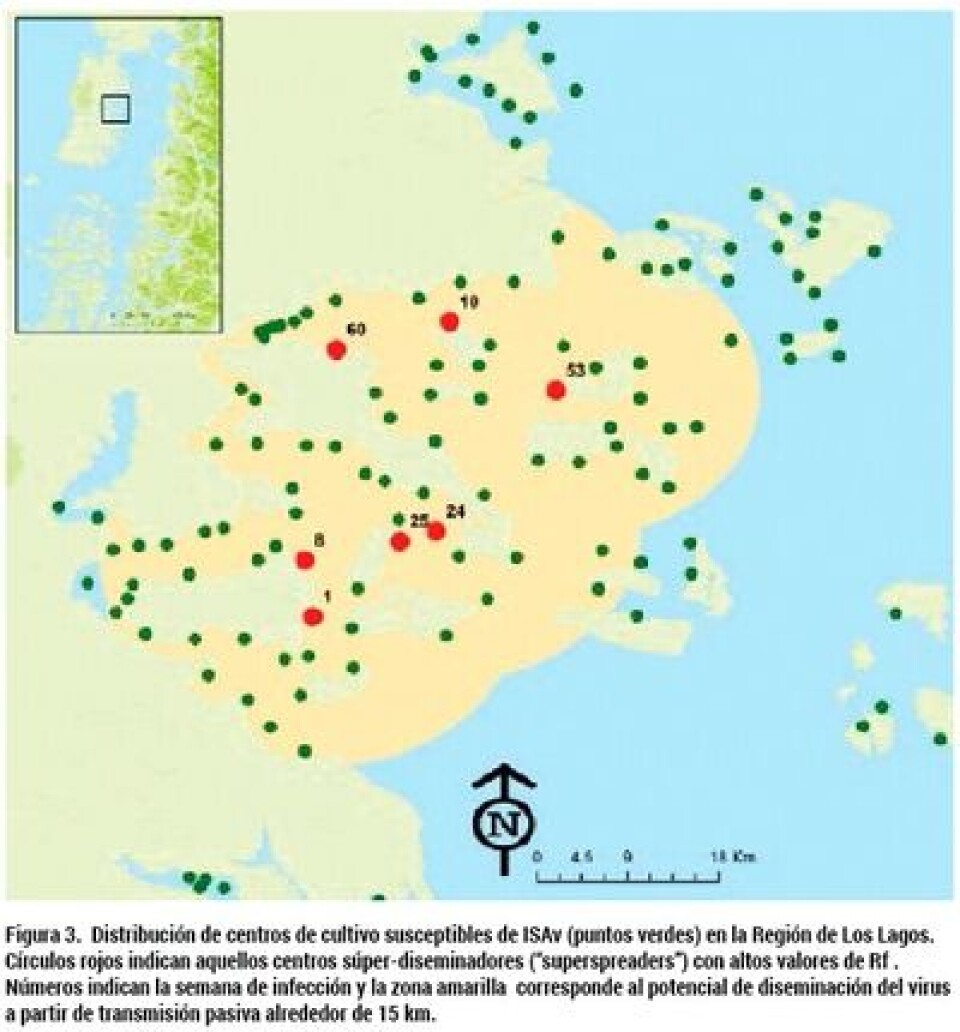
Análisis espaciales identificaron la presencia de centros súper-diseminadores, que fueron definidos como aquellos centros que transmitieron ISAv a centros con peces susceptibles a una tasa que excedió la tasa de transmisión para una fracción de todos aquellos infectados (Woolhouse y col. 2005; Matthews y col. 2006). El impacto de estos centros súper-diseminadores fue evidente durante la fase inicial de diseminación de la epidemia, dado que sólo tres centros pudieron haber generado 13 de los 21 casos iniciales (62%), lo que es consistente con la regla 20/80 que postula que alrededor de un 20% de los individuos mas infecciosos son responsables del 80% de la transmisión de la enfermedad (Woolhouse y col. 1997). Los resultados de este estudio tienen importantes implicancias prácticas y consecuencias para el diseño e implementación de estrategias de intervención. Por ejemplo, si fuera posible identificar en forma temprana aquellos super-diseminadores, sería posible mejorar en forma significativa la eficiencia en los esfuerzos de control enfocándose en los más infecciosos en vez de intervenciones establecidas de forma aleatoria (Lloyd-Smith y col. 2005). Las estimaciones de las distancia promedio (15 km) en la Región de Los Lagos fueron consistentes con el tamaño de los clústeres espacio-temporales reportados previamente (Mardones y col. 2009) y casi la mitad de la distancia promedio estimada en la Región de Aysén (25,4 km). Esto sugiere que las estrategias de control debieran enmarcarse en un radio entre 10-15 km y no 5km como lo sugiere la OIE. Actualmente, Sernapesca establece un área de control de 5,5 millas náuticas, que equivalen a 10 kilómetros (Res. N° 3889).

Diseminación de ISAv dentro de un centro de cultivo La diseminación de ISAv dentro de centros de cultivo de salmón Atlántico fue investigada a partir de una submuestra de 23 centros que entregaron información detallada con respecto a la secuencia de eventos y diagnósticos de jaulas de cultivo dentro de un centro infectado (Mardones y col. 2013). En general, una vez que un centro se infecta, cerca del 57% de las jaulas muestran positividad en algún momento, en un periodo variable de tiempo que en promedio corresponde a las 30 semanas (duración de un brote) (Tabla 1). En aquellos centros donde además de positividad existían mortalidades asociadas con ISA y un mayor número de peces totales en el centro, fueron identificados como predictores de una mayor magnitud de la diseminación del brote. Lo reportado en Chile es similar a lo descrito en Estados Unidos (Gustafson y col. 2007). En ambos países no se logró demostrar una relación espacio-temporal de casos dentro de un centro, y se identificaron muy pocos predictores. En este sentido, la manifestación clínica dentro de un centro estaría asociada con una mayor tasa de diseminación de agentes virales a partir de individuos muertos y enfermos. Otra posibilidad estaría asociada con ciertas prácticas que son implementadas ante un aumento de mortalidad que involucran una mayor manipulación y manejos de material contaminado, que de ser mal ejecutadas, implicaría una mayor dispersión del virus. En tanto, un mayor número de peces implicarían un mayor número de unidades productivas, aumentando así la posibilidad de dispersión. En cierta medida, este efecto de denso-dependencia es esperable, puesto que a mayor cantidad de peces que puedan estar infectados, la probabilidad de dispersión también es mayor. Una conclusión importante en este estudio, es que la remoción de jaulas infectadas debiera ser muy agresiva y rápida si se pretende controlar un brote de ISA. Eso sí, considerando la distinción entre positividad sin signología clínica asociada versus la presencia de peces enfermos y mortalidad atribuible a ISA. En una situación como la última, es necesario destinar mayores recursos y tiempo adicional para reducir el impacto de ISAv, dado que el riesgo aumenta tres veces más. Esto último se agrava si el centro tiene una mayor cantidad de peces.
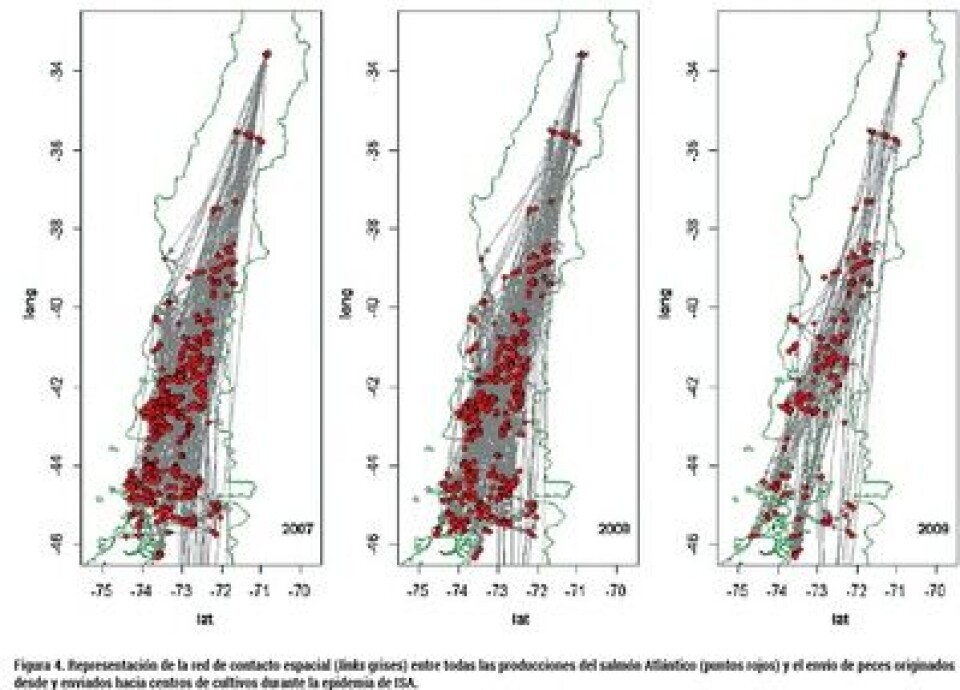
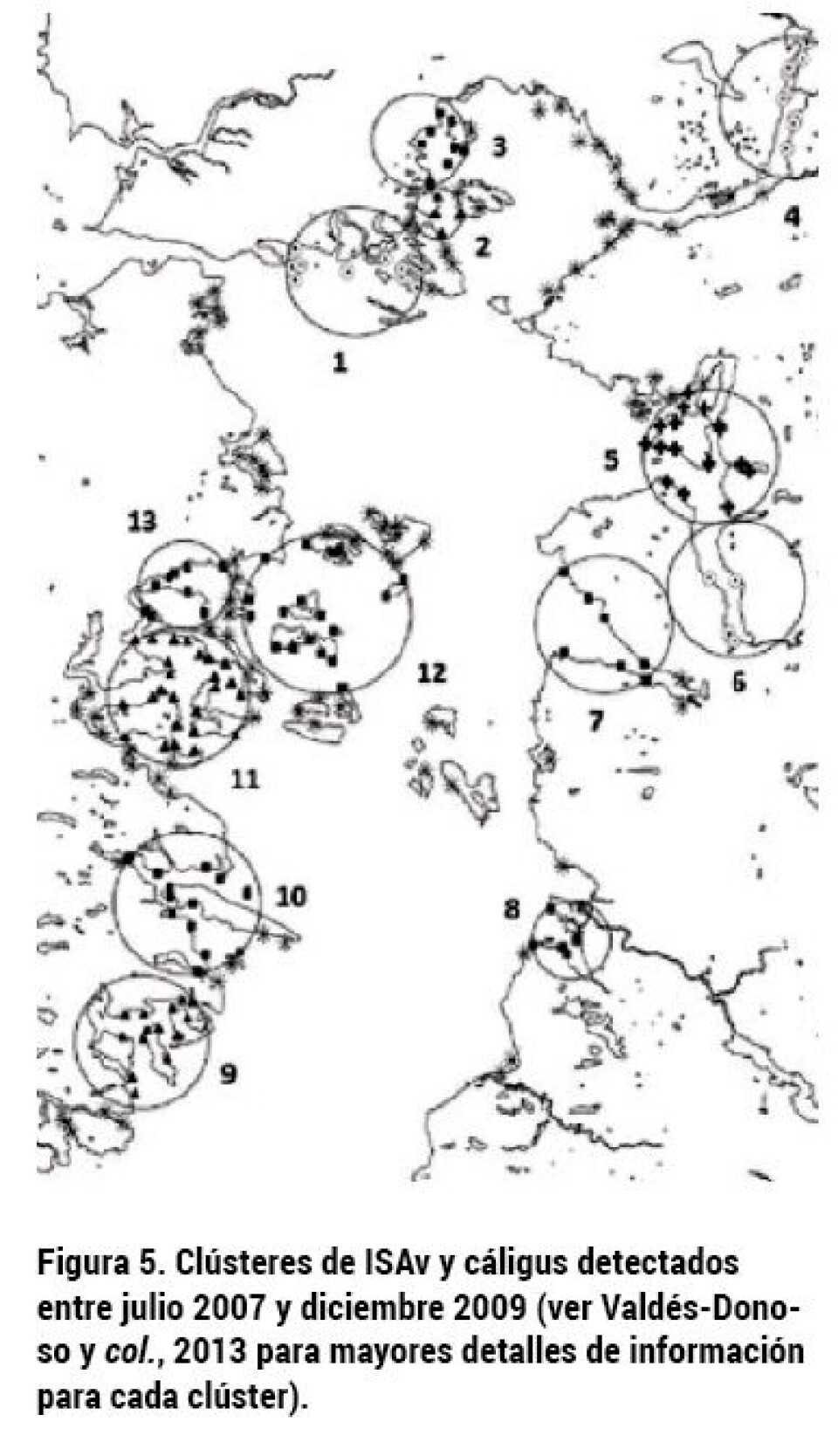
Factores de riesgo adicionales y el rol del movimiento de peces durante la epidemia. En un nuevo estudio (Mardones y col. 2014), una serie de factores de riesgo fueron identificados como significativos en la aparición mas temprana o tardía del reporte de ISAv. A su vez, se investigó por primera vez en la industria el rol de la red de contacto en los movimientos de peces durante la epidemia (Figura 4). La existencia de múltiples generaciones en un centro, un mayor número de ingresos, centros mas grandes, y peces con pesos de ingreso mayores, fueron identificados como factores de riesgo que disminuyeron el tiempo a la aparición de ISAv durante la epidemia. A su vez, una mayor distancia entre centros retardó la aparición de ISAv, y tal como se ha reportado en varias partes, el movimiento de peces demostró estar asociado con un mayor riesgo para la dispersión de patógenos. En este estudio, al menos siete centros de cultivo pudieron haber recibido peces infectados durante su período de incubación, lo que significa que un 3% (siete casos de un total de 239) de las infecciones por ISAv podrían ser atribuidas al movimiento de peces vivos. Si bien esta proporción podría ser considerada baja, las consecuencias de dichos movimientos podrían resultar de una epidemia mayor, debido a las características de la transmisión local (Mardones y col. 2009). Más aún, dependiendo de las características del centro que recibe los peces, podría existir un efecto multiplicador de estos súper-diseminadores (Mardones y col. 2011), quienes al tener un Rf entre 1,7 y 2,3 (asumiendo un valor de referencia Rf = 2) es posible que aproximadamente 14/239 (±6%) de los centros fueran infectados por el movimiento de peces y subsecuente dispersión local. Patrones de co-infección entre ISAv y caligidiosis En un estudio retrospectivo se logró determinar un mayor riesgo de co-infección entre ISAv y caligidiosis en determinadas áreas de la Región de Los Lagos (Valdes-Donoso y col. 2013). El estudio determinó que la implementación de ciertas prácticas de manejo, en particular, la estrategia coordinada de tratamientos, reducirían el riesgo a ambas enfermedades. Específicamente, del total de 13 clústeres espacio-temporales identificados en el estudio, nueve de ellos reportaron altas cargas de cáligus, los cuales además estaban asociados con ciertas prácticas de manejo. Áreas en las cuales buenas prácticas de manejo estaban implementadas, efectivamente redujeron el riesgo a la co-infección.
Conclusiones finales El conjunto de investigaciones llevadas a cabo en UC Davis entregaron resultados valiosos con respecto a la epidemia más grande registrada en el mundo de ISAv. En las primeras investigaciones se describió la dispersión inicial en la Región de Los Lagos y al aparición de clústeres espacio-temporales que limitaban un mayor riesgo de infección al centro del archipiélago de Chiloé, comparado con el resto de la región. Posteriormente, la dinámica de la transmisión de ISAv entre centros de cultivo cuantificó un parámetro esencial para determinar la magnitud de un primer centro infectado, a su vez que es un componente esencial para la construcción de modelos epidemiológicos de simulación que permitan la evaluación de alternativas de control y estrategias de intervención para evaluar futuras epidemias. Debido a que el centro de cultivo es a menudo la unidad fundamental de control durante una epidemia, el estudio a este nivel cuantificó ciertos indicadores epidemiológicos que son esenciales para las políticas de su control, y permiten entender y magnificar el impacto de una infección en un centro de cultivo. También se demostró la importancia de la transmisión a larga distancia producto del movimiento de peces, y el rol que éste jugó durante la epidemia, en conjunto con un grupo de factores de riesgo importantes a la hora de prevenir, detectar y controlar futuras epidemias en Chile. Finalmente, se entregan evidencias donde la co-infección de ISAv y cáligus en ciertas áreas de la Región de Los Lagos, resulta de la combinación de algunas prácticas de manejo que, bien aplicadas, lograron efectivamente reducir el riesgo de ambas enfermedades.
References Boender, G.J., van den Hengel, R., van Roermund, H.J.W., Hagenaars, T.J., 2014. The Influence of Between-Farm Distance and Farm Size on the Spread of Classical Swine Fever during the 1997-1998 Epidemic in The Netherlands. Plos One 9. Godoy, M.G., Aedo, A., Kibenge, M.J., Groman, D.B., Yason, C.V., Grothusen, H., Lisperguer, A., Calbucura, M., Avendano, F., Imilan, M., Jarpa, M., Kibenge, F.S., 2008. First detection, isolation and molecular characterization of infectious salmon anaemia virus associated with clinical disease in farmed Atlantic salmon (Salmo salar) in Chile. BMC Vet Res 4, 28. Gustafson, L., Ellis, S., Robinson, T., Marenghi, F., Merrill, P., Hawkins, L., Giray, C., Wagner, B., 2007. Spatial and non-spatial risk factors associated with cage-level distribution of infectious salmon anaemia at three Atlantic salmon, Salmo salar L., farms in Maine, USA. Journal of fish diseases 30, 101-109. Karlsson, M., Nilsson, T., Pichler, S., 2014. The impact of the 1918 Spanish flu epidemic on economic performance in Sweden An investigation into the consequences of an extraordinary mortality shock. J Health Econ 36, 1-19. Lloyd-Smith, J.O., Schreiber, S.J., Kopp, P.E., Getz, W.M., 2005. Superspreading and the effect of individual variation on disease emergence. Nature 438, 355-359. Mardones, F.O., Jansen, P.A., Valdes-Donoso, P., Jarpa, M., Lyngstad, T.M., Jimenez, D., Carpenter, T.E., Perez, A.M., 2013. Within-farm spread of infectious salmon anemia virus (ISAv) in Atlantic salmon Salmo salar farms in Chile. Diseases of aquatic organisms 106, 7-16. Mardones, F.O., Martinez-Lopez, B., Valdes-Donoso, P., Carpenter, T.E., Perez, A.M., 2014. The role of fish movements and the spread of infectious salmon anemia virus (ISAv) in Chile, 2007-2009. Preventive veterinary medicine 114, 37-46. Mardones, F.O., Perez, A.M., Carpenter, T.E., 2009. Epidemiologic investigation of the re-emergence of infectious salmon anemia virus in Chile. Diseases of aquatic organisms 84, 105-114. Mardones, F.O., Perez, A.M., Valdes-Donoso, P., Carpenter, T.E., 2011. Farm-level reproduction number during an epidemic of infectious salmon anemia virus in southern Chile in 2007-2009. Preventive veterinary medicine 102, 175-184. Matthews, L., Low, J.C., Gally, D.L., Pearce, M.C., Mellor, D.J., Heesterbeek, J.A.P., Chase-Topping, M., Naylor, S.W., Shaw, D.J., Reid, S.W.J., Gunn, G.J., Woolhouse, M.E.J., 2006. Heterogeneous shedding of Escherichia coli O157 in cattle and its implications for control. P Natl Acad Sci USA 103, 547-552. Murray, A.G., Smith, R.J., Stagg, R.M., 2002. Shipping and the spread of infectious salmon anemia in Scottish aquaculture. Emerging infectious diseases 8, 1-5. Ster, I.C., Dodd, P.J., Ferguson, N.M., 2012. Within-farm transmission dynamics of foot and mouth disease as revealed by the 2001 epidemic in Great Britain. Epidemics-Neth 4, 158-169. Valdes-Donoso, P., Mardones, F.O., Jarpa, M., Ulloa, M., Carpenter, T.E., Perez, A.M., 2013. Co-infection patterns of infectious salmon anaemia and sea lice in farmed Atlantic salmon, Salmo salar L., in southern Chile (20072009). Journal of fish diseases 36, 353-360. Woolhouse, M.E.J., Dye, C., Etard, J.F., Smith, T., Charlwood, J.D., Garnett, G.P., Hagan, P., Hii, J.L.K., Ndhlovu, P.D., Quinnell, R.J., Watts, C.H., Chandiwana, S.K., Anderson, R.M., 1997. Heterogeneities in the transmission of infectious agents: Implications for the design of control programs. P Natl Acad Sci USA 94, 338-342. Woolhouse, M.E.J., Shaw, D.J., Matthews, L., Liu, W.C., Mellor, D.J., Thomas, M.R., 2005. Epidemiological implications of the contact network structure for cattle farms and the 20-80 rule. Biol Lett-Uk 1, 350-352. Wright, C.F., Knowles, N.J., Di Nardo, A., Paton, D.J., Haydon, D.T., King, D.P., 2013. Reconstructing the origin and transmission dynamics of the 1967-68 foot-and-mouth disease epidemic in the United Kingdom. Infect Genet Evol 20, 230-238.




















