Efecto de la temperatura del agua y la infección experimental concomitante entre Piscirickettsia salmonis y Renibacterium salmoninarum en truchas arcoíris (Oncorhynchus mykiss)
Julio Larenas1, María Teresa Calderón2 1 Universidad de Chile. Laboratorio Nacional de Referencia para el diagnóstico de enfermedades de especies hidrobiológicas, Facultad de Ciencias Veterinarias y Pecuarias. juliolarenas@gmail.com 2 Universidad Mayor.
Introducción Hasta la fecha, los intentos para evitar la presentación de Piscirickettsiosis han sido infructuosos. Para reducir las pérdidas, los centros de cultivo han disminuido las densidades poblacionales por jaula, entre otras medidas. Al respecto, los trabajos experimentales realizados por Larenas y col., (1997), han demostrado que en trucha arcoíris inoculadas con Piscirickettsia salmonis (Cepa LF-89), la mortalidad aumenta cuando los peces son sometidos a una mayor densidad poblacional y cuando la temperatura del agua es cercana a los 14 °C.
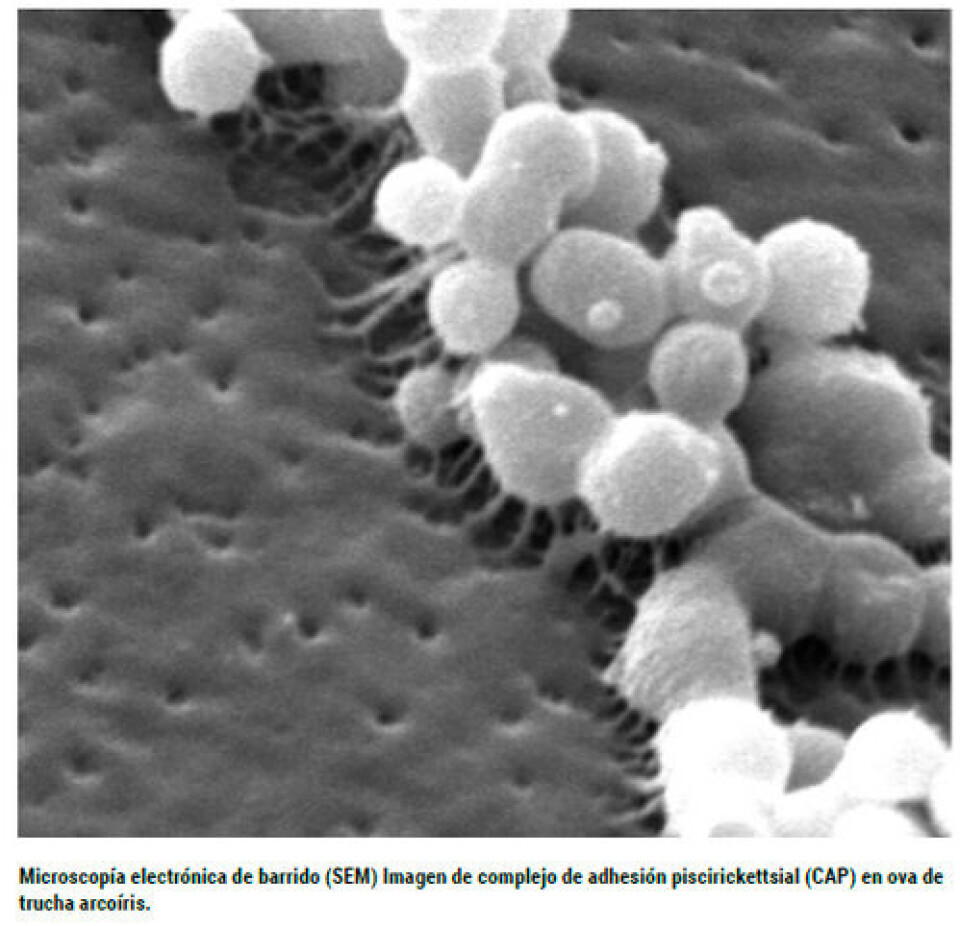
Larenas y col., (1995) han sugerido que P. salmonis es un agente inmunosupresor que podría predisponer a la acción de otros patógenos. En tanto, Renibacterium salmoninarum, agente etiológico de la denominada Enfermedad Bacteriana del Riñón (BKD, por sus siglas en inglés), es una bacteria que se encuentra ampliamente distribuida en los salmónidos, a la cual también se le ha atribuido un efecto de disminuir la respuesta inmune (Fryer y Lannan, 1993). Hasta el momento, no existen antecedentes publicados que indiquen si la presencia concomitante de estas bacterias favorece la presentación de mortalidad y si ésta tiene alguna relación con la temperatura del agua a la que están expuestos los peces. En el presente trabajo se reportan los resultados obtenidos, medidos en mortalidad, al inocular a truchas arcoíris vía intraperitoneal con ambos agentes y someterlas a diferentes temperaturas del agua.
Metodología Peces. Se utilizaron truchas arcoíris (Oncorhynchus mykiss) de aproximadamente 20 g (n=615) clínicamente sanas, provenientes de una piscicultura ubicada en la Región Metropolitana, Santiago, Chile, zona en la cual no existen antecedentes de la existencia de brotes o infección por Piscirickettsiosis. Los peces fueron sometidos a un período de cuarentena y adaptación de tres semanas previas a la inoculación, tiempo durante el cual se les realizaron controles de salud. Al respecto, 30 peces fueron seleccionados al azar, eutanasiados, y analizados mediante un estudio de necropsia e histopatología de riñón, hígado, branquias y bazo. Además, de las muestras renales se obtuvieron frotis para realizar la prueba de inmunofluorescencia indirecta (IFI) para la detección de P. salmonis, según lo descrito por Lannan y col., (1991) y modificado por Larenas y col., (1996). Además, cada frotis fue evaluado mediante inmunofluorescencia directa (IFD) con anticuerpos anti-Renibacterium salmoninarum de acuerdo con la metodología propuesta por Bullock y col., (1980). A las 24 horas de la llegada de los peces a la unidad experimental, éstos fueron sometidos a un baño contra hongos y parásitos externos como medida de prevención. Asimismo, cada uno de ellos fue inyectado intraperitonealmente con 0,1 mL de una solución de eritromicina inyectable en una dosis de 100 mg/kg de peso. Diez peces fueron nuevamente evaluados para determinar su condición sanitaria a los 15 días posteriores al tratamiento con eritromicina.
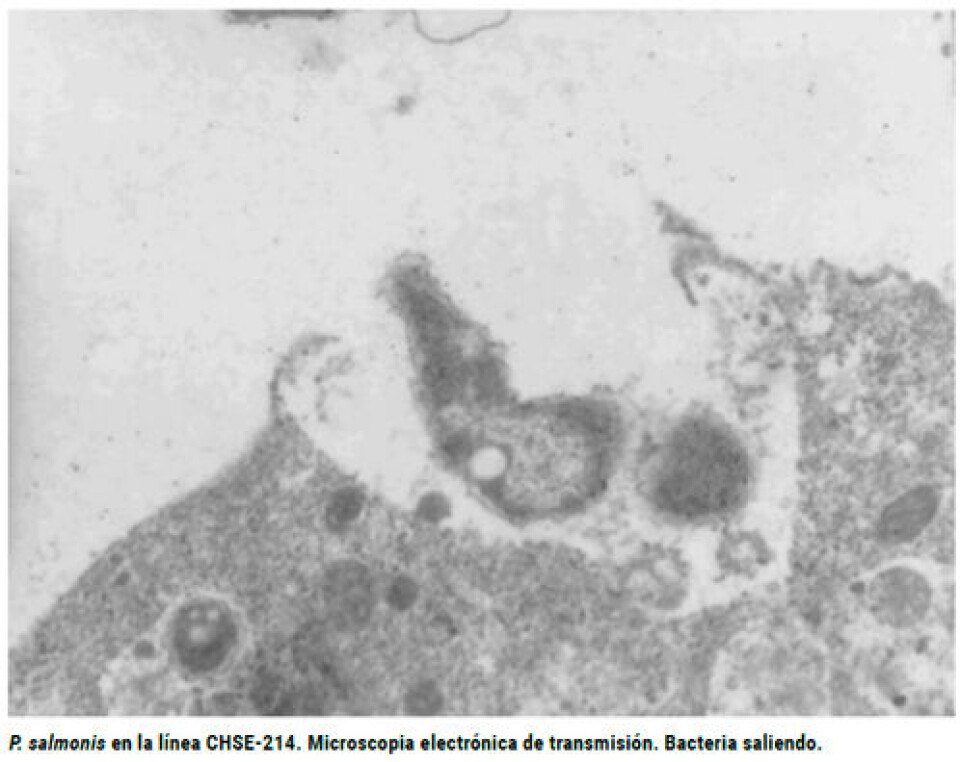
Los peces fueron divididos en nueve grupos experimentales de 50, siendo a su vez cada uno subdividido en duplicados de 25. Los grupos fueron inoculados con P. salmonis y/o R. salmoninarum, y mantenidos a una de las tres temperaturas utilizadas, es decir, 8 ºC (±0,5), 14 ºC (± 0,8) y 18 ºC (± 0,4). Todos los grupos fueron mantenidos a una densidad poblacional de 20 kg/m3 durante todo el periodo experimental que duró 46 días postinoculación (PI). Cada pez fue inyectado intraperitoneal (IP) con una suspensión de cultivo celular inoculado previamente con un aislado de P. salmonis y/o con R. salmoninarum cultivado previamente en un medio líquido. Como grupos controles de inóculo, se inyectaron, además, peces con medio esencial mínimo (n=50) o con solución salina estéril (PBS) (n=50). Otro grupo de peces (n=25) no fue sometido a ningún tratamiento. La menor temperatura del agua (8 ºC±0,4ºC) fue mantenida mediante unidades de refrigeración. La temperatura de 14+0,8 ºC correspondió a la temperatura de la red de agua potable de la ciudad de Santiago. La temperatura más elevada (18 ºC±0,4 ºC) fue mantenida en forma individual mediante termocalefactores. Las temperaturas de los estanques fueron alcanzadas en forma gradual para los grupos a baja y alta temperatura, por un período de una semana. Durante el transcurso del experimento se tomaron muestras de frotis renales de todos los peces moribundos y muertos, para realizar IFI para la detección de P. salmonis e IFD para R. salmoninarum. El mismo procedimiento se realizó al término del ensayo con todos los peces sobrevivientes (46 días PI).
Línea celular Para la mantención y multiplicación de P. salmonis, se empleó la línea CHSE.214 libre de antibióticos, de acuerdo con la metodología de Fryer y col., (1990). P. salmonis. Se utilizó un aislado de la bacteria que fue mantenida y multiplicada en la línea celular CHSE-214. La bacteria fue cultivada a 17 – 18 ºC hasta observar un efecto citopático cercano a un 100% en la monocapa. El sobrenadante fue titulado mediante diluciones en microplacas de 24 pocillos y el título final fue calculado mediante la técnica de Reed y Muench (1938), correspondiendo a 105,8 TCID50/mL. R. salmoninarum. Se utilizó un aislado obtenido a partir de salmones del Atlántico afectados por un brote de BKD en el sur de Chile. El aislamiento primario se realizó a partir de muestras de riñón, que se sembraron en medio sólido con carbón activado de acuerdo con la metodología de Evelyn (1977) y modificada por Daly y Stevenson (1985). La bacteria fue cultivada en una estufa a 15 ºC por un período de ocho semanas, periodo después del cual fueron elegidas las colonias según su aspecto macroscópico. De cada colonia seleccionada se realizó previamente un Gram e IFD para R. salmoninarum, de acuerdo con la metodología antes descrita. Las colonias fueron luego sembradas en medio KDM-2 líquido y sólido (Evelyn, 1977 y cultivadas a una temperatura de 15 ºC por un período de seis semanas. El cultivo en medio líquido fue agitada diariamente dos veces al día (Evelyn y col., 1990). Al término del período de incubación (cuatro semanas), los tubos fueron centrifugados a 1.500 rpm por 5 min. El “pellet” obtenido fue re-suspendido en PBS estéril y, posteriormente, titulado en diluciones a la décima, en medio agar KDM-2. La concentración ocupada para inocular a los peces fue calculada mediante la técnica de McFarland, para ajustar a 2,7 x 108 bacterias/mL en salina/peptona, de acuerdo con la metodología empleada por Bruno y Munro (1986). Análisis estadístico. Los valores de mortalidad final obtenidos para cada grupo experimental, se compararon mediante la prueba de homogeneidad que usa la distribución de chi cuadrado (χ2). Además, para cada grupo experimental se construyó una tabla de supervivencia comparándose los valores mediante la prueba de Wilcoxon (Lee, 1980).
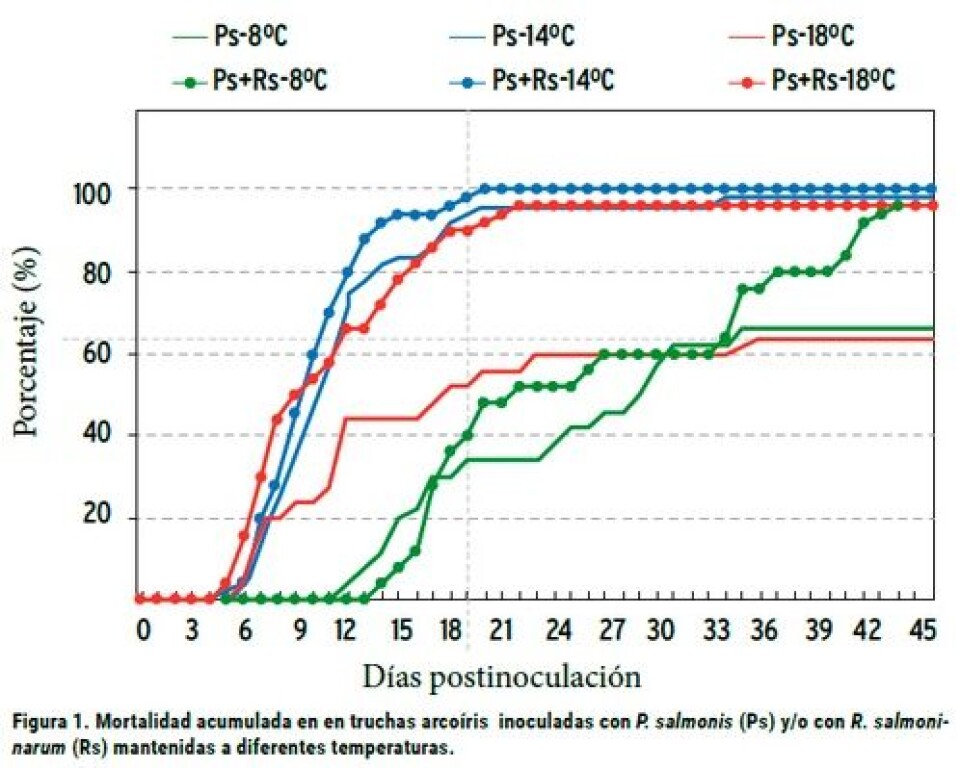
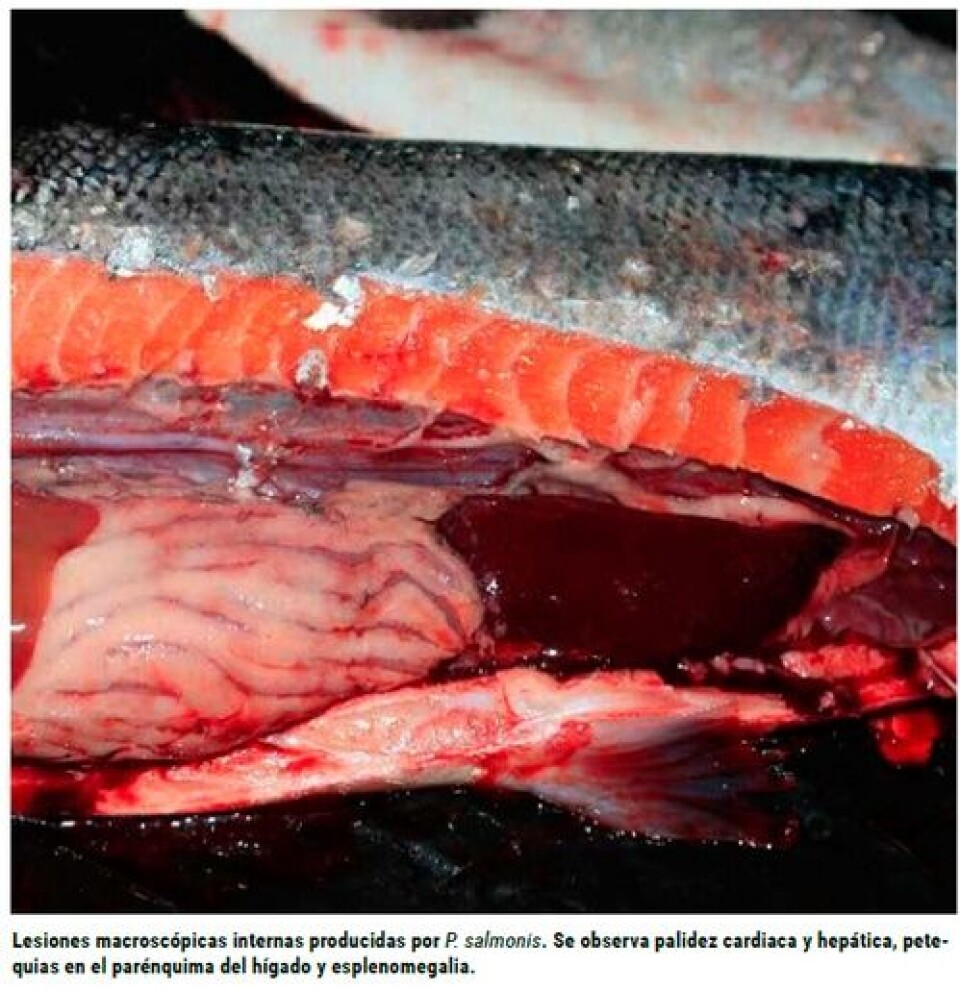
Resultados y discusión Durante el desarrollo del experimento (46 días PI), se produjo mortalidad en todos los grupos inoculados ya sea con P. salmonis y/o R. salmoninarum, pero no así en los grupos controles (Figura 1). Los 30 peces analizados para el control de salud, resultaron negativos a la presencia de P. salmonis y seis de ellos ligeramente positivos a R. salmoninarum mediante inmunofluorescencia, aunque ninguno presentó lesiones macroscópicas o histopatológicas atribuibles a este microorganismo. Las lesiones macroscópicas en todos los peces moribundos o muertos, inoculados con P. salmonis, fueron similares a las descritas para la enfermedad. Lo mismo ocurrió con los peces inoculados con R. salmoninarum. Al analizar las curvas de mortalidad producidas por la P. salmonis, a 14 ºC se obtuvo un 98% de mortalidad acumulada, lo cual fue significativamente superior respecto de las otras dos temperaturas (p≤ 0,05), no evidenciándose diferencias significativas entre la producida a 8 ºC (66%) y a 18 ºC (64%). Si se analizan estos resultados, se concluiría que el patógeno se comporta en forma similar en temperaturas extremas, sin embargo, si se observa con más detalle la figura 1, se aprecian diferencias al inicio de la mortalidad. El análisis de supervivencia demostró, no obstante, que existen diferencias entre los tres grupos, lo cual demuestra que la temperatura del agua tiene un efecto sobre la curva de mortalidad. Todos los grupos de peces afectados por BKD tuvieron mortalidades, cuyas curvas difirieron de acuerdo con las temperaturas analizadas. Al igual que para los grupos infectados con P. salmonis, la mayor mortalidad se obtuvo con los peces mantenidos a 14 ºC, lo cual se acerca a la temperatura óptima de crecimiento in vitro del patógeno (Evelyn, 1977; Austin y col., 1983; Evelyn y col., 1990). Al respecto, Sanders y col., (1978) comprobaron que las temperaturas de 15 a 18 ºC favorecen el desarrollo de cuadros crónicos de BKD en salmón sockeye en condiciones naturales. De acuerdo con los resultados y su respectivo análisis estadístico, se puede inferir que la cepa de R. salmoninarum utilizada produce altas mortalidades cuando los peces se mantienen en temperaturas cercanas a los 14 ºC. Temperaturas extremas determinan valores finales inferiores, aunque el inicio de la mortalidad es diferente. La inoculación simultánea de los dos agentes en estudio produjo en general un efecto sinérgico, llevando a un aumento de las mortalidades, en relación con la aplicación de los microorganismos en forma única. Brown y col., (1996), han demostrado un efecto inmunosupresor de una proteína propia de R. salmoninarum. Ésta corresponde a un producto extracelular que estaría relacionado directamente con la respuesta inmune en los salmónidos. Posee un peso molecular de 57 kDa (p57) y tiene in vitro una actividad de hemaglutinina y leucoaglutinina. De acuerdo con lo anterior, es posible que en condiciones naturales los peces infectados moderadamente por R. salmoninarum, presenten cuadros más severos de Piscirickettsiosis, especialmente con temperaturas que superen en promedio los 14 ºC. Sin embargo, hay que tener presente que se requieren más estudios, especialmente en condiciones de agua salada, que es el medio donde naturalmente se expresan ambas enfermedades.
Referencias Austin B., T.M. Embley, M. Goodfellow. 1983. Selective isolation of Renibacterium salmoninarum. FEMS Microbiol Lett. 17: 111 – 114. Brown L.L., G.K. Iwama, T.P.T. Evelyn. 1996. The effect of early exposure of Coho salmon (Oncorhynchus kisutch) eggs to the p57 protein of Renibacterium salmoninarum on the development of immunity to the pathogen. Fish and Shellfish Immun 6: 149 – 165. Bruno D.W., L.S. Munro. 1986. Haematological assesment of rainbow trout, Salmo gairdneri Richarson, and Atlantic salmon, Salmo salar L., infected with Renibacterium salmoninarum. J Fish dis 9: 195 – 204. Bullock G.L., B.R. Griffn, H.M. Stuckey. 1980. Detection of Corynebacterium salmoninus by direct fluorescent antibody test. Can J Fish Aquat Sci 37: 719-721. Daly J.G., Stevenson R.M. 1985. Charcoal agar, a new growth medium for the fish disease bacterium Renibacterium salmoninarum. Appl Environ Microb 50: 868 – 871. Evelyn T.P.T. 1977. An improved growth for the kidney disease bacterium and some notes on using the medium. Bull. Off. Int. Epiz. 87: 511-513. Evelyn T.P.T., L. Prosperi-Porta, J.E. Ketcheson. 1990. Two new techniques for obtaining consistent results when growing Renibacterium salmoninarum on KDM2 culture medium. Dis Aquat Org 9: 209-212. Fryer J.L, C. Lannan, L. Garcés, J. Larenas, P. Smith. 1990. Isolation of a rickettsiales-like organism from diseased Coho salmon (Oncorhynchus kisutch) in Chile. Fish Pathol 25: 107-114. Fryer J.L., C.N. Lannan. 1993. The history and current status of Renibacterium salmoninarum, the causative agent of bacterial kidney disease in Pacific salmon. Fish Res 17: 15-33. Lannan C., S.A. Ewing, J.L. Fryer. 1991. A fluorescet antibody test for detection of rickettsia causing disease in Chilean salmonids. J Aquat Anim Health 3: 229-234. Larenas J., L. Hidalgo, H. Garcés, J.L. Fryer, P. Smith. 1995. Piscirickettsiosis: Lesiones en salmón Atlántico (Salmo salar) infectados naturalmente con Piscirickettsia salmonis. Av Cs Vet 10: 53-58. Larenas, J., C. Astorga, J. Contreras, H. Garcés, J. Fryer, P. Smith. 1996. Rapid detection of Piscirickettsia salmonis using microwave irradiation. Fish Pathol 31(4): 231-232. Larenas, J., J. Contreras, S. Oyanedel, M.A. Morales, P. Smith. 1997. Efecto de la densidad poblacional y temperatura en truchas arcoíris (Oncorhychus mykiss) inoculadas con Piscirickettsia salmonis. Arch Med Vet 29: 113-119. Lee E. 1980. Statical methods for survival data analysis. University of Oklahoma, California, Estados Unidos 537 p. Reed L.J., H. Muench. 1938. A simple method of stimating fifty percent endpoints. American Journal of Hygiene 27: 497-499. Sanders J.F., K.S. Pilcher, J.L. Fryer. 1978. Relation of water temperature to bacterial kidney disease in coho salmon (Oncorhynchus kisutch), sockeye salmon (O. nerka), and steelhead trout (Salmo gairdneri). J Fish Board Can 35: 8-11.
















