La lucha del hospedero frente a Piscirickettsia salmonis
Alex Romero1,3, Jaime Figueroa2,3, Roxana González-Stegmaier1,3 1 Facultad de Ciencias Veterinarias, Universidad Austral de Chile, Valdivia, Chile2 Facultad de Ciencias, Universidad Austral de Chile, Valdivia, Chile3 Centro Fondap: Interdisciplinary Center for Aquaculture Research (Incar), Chile
El conocimiento del sistema inmune de los peces es más limitado en comparación con lo que ya se conoce en los mamíferos. Sin embargo, existe un grado importante de similitud entre las defensas de peces con lo descrito para vertebrados superiores, siendo los teleósteos uno de los primeros grupos evolutivos en desarrollar el sistema inmune adaptativo o específico. Sin embargo, a nivel de órganos y tejidos inmunes, los peces presentan como principales tejidos linfoides el timo, riñón anterior o cefálico, bazo y tejidos asociados a las mucosas, la piel y branquias. Más aún, a diferencia de los mamíferos, los peces no poseen médula ósea, sistema linfático, ni placas de Peyer (Imarai, 2008). Otra característica propia de los peces, es el hecho que su sistema inmune está condicionado no sólo por el medio ambiente acuático, sino también por su condición de poiquilotermos, por lo que necesitan adaptarse a grandes cambios ambientales de temperatura, niveles de oxígeno, salinidad, etc. (Tort y col., 2003).
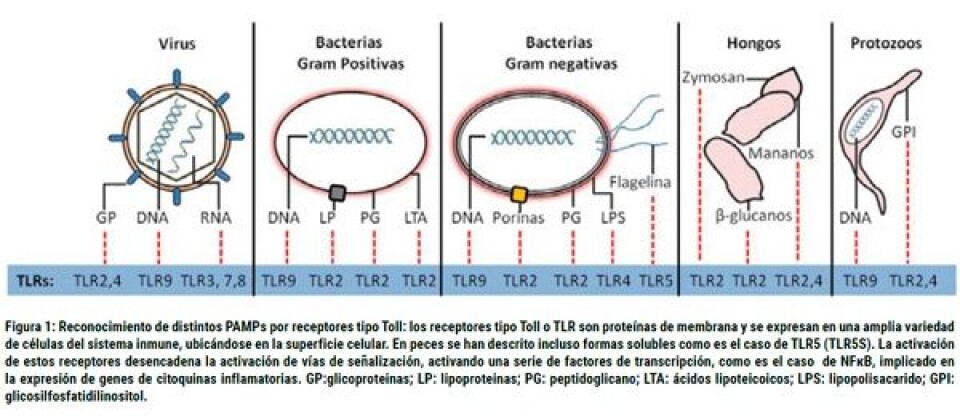
Respuesta inmune innata o no específica Más del 98% de los organismos pluricelulares son capaces de mantener su integridad gracias a un sistema inmune innato. La inmunidad innata corresponde a una serie de mecanismos defensivos altamente conservados durante la evolución y de respuesta rápida, que se caracteriza por ser inespecífico al reconocer Patrones Moleculares Asociados a Patógenos (PAMPs, por sus siglas en inglés), y que corresponden a moléculas propias de microorganismos afines (LPS, DNA, RNA, peptidoglicanos, β-glucanos etc) y que son reconocidos por Receptores de Reconocimientos de Patrones (PRRs, por sus siglas en inglés), entre los que se cuentan los receptores Tipo Toll (TLR, por sus siglas en inglés) (Figura 1). Estos mecanismos defensivos no poseen memoria, es constitutiva (siempre está presente), reaccionan en un plazo muy corto, son capaces de reconocer “lo propio” y no dependen de reconocimiento previo de las estructuras antigénicas del invasor (Tort y col., 2003). A nivel celular, el sistema inmune no específico está basado, principalmente, en respuestas inflamatorias que implican reacciones celulares, llevadas a cabo por células fagocíticas capaces de fagocitar elementos extraños y producir moléculas involucradas en mecanismos oxidativos. También existen factores humorales, como el complemento, peroxidasas, lisozimas, proteínas de fase aguda, los que en su conjunto están implicados en la respuesta a patógenos (Alvarez-Pellitero, 2008). Asimismo, la inmunidad innata presenta células tipo Natural Killer o también denominadas células citotóxicas no específicas NCCs. Este tipo celular, identificado inicialmente en catfish, muestra que son morfológica y funcionalmente similares a las NK, usando vías efectoras similares para la destrucción de células tumorales y células infectadas por virus, como los mecanismos de citotoxicidad mediados por receptores de citotoxicidad natural (NCR) y receptores inhibitorios de células NK (inhibitory NK-cell receptors, iNKRs), que mediante su interacción con el Complejo Mayor de Histocompatibilidad tipo I (CMH tipo I), activan o inhiben la muerte celular de células infectadas o tumorales (Figura 2). Se han detectado NCCs en la sangre periférica, bazo, hígado y, por último, en el riñón de los peces, formando parte de las células involucradas en el sistema inmune innato de los peces teleósteos, ejerciendo su actividad citotóxica, contra virus, protozoarios y parásitos intracelulares (Rubio-Godoya, 2010).
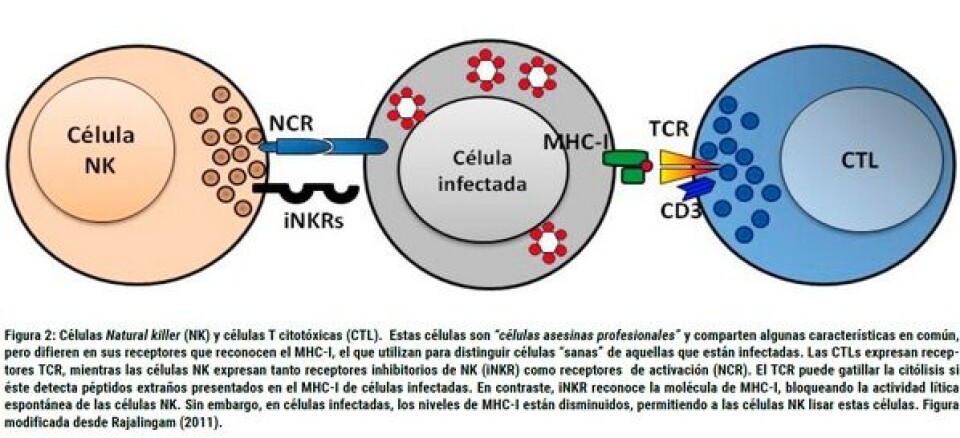
Respuesta inmune adaptativa o específica Dentro del sistema inmune, esta respuesta engloba los mecanismos más complejos y desarrollados, se caracteriza por su especificidad y capacidad de memoria y está compuesta por dos tipos de respuesta: la respuesta humoral, mediada por anticuerpos y desarrollada básicamente en el medio extracelular; y la respuesta celular, mediada por linfocitos T y con acción intracelular. Es importante mencionar que ambas respuestas se determinan en gran medida por las células presentadoras de antígenos, entre las que se destacan las dendríticas, descritas funcionalmente en peces y que producen citoquinas, que ya sea favorecen la respuesta humoral o celular (Bassity & Clark, 2012). En el caso de las bacterias intracelulares, la rápida producción de interleuquina-12 (IL-12) por células dendríticas y macrófagos, es crucial en la respuesta protectora. Esta citoquina favorece la respuesta de tipo celular (Imarai, 2008). De hecho, citoquinas como IL-2, IL-12, IL-18, IFN-γ y TNF-β defienden al hospedero contra patógenos intracelulares mediante la activación de los macrófagos, mejorando la presentación de antígenos y la inducción de la diferenciación de células T, lo cual se denomina respuesta de tipo Th1. En contraste, la citoquinas que incluyen IL-4, IL-5, IL-10 e IL-13, coordinan principalmente respuestas inmunes contra patógenos extracelulares mediada por anticuerpos, lo cual se denomina respuesta de tipo Th2 (Zou y col., 2005). Respuesta celular específica La inmunidad celular es necesaria cuando los agentes patógenos escapan al sistema humoral, ubicándose en el interior de las células, como ocurre en las infecciones víricas. En vertebrados superiores esta función la ejercen los linfocitos T citotóxicos (Tc o CTL) y células NK. De este modo, los antígenos intracelulares son presentados a los linfocitos Tc mediante el CMH tipo I. El CMH tipo I presenta péptidos propios, procedentes de las proteínas de la célula, y en el caso de células infectadas por virus, estos péptidos son de origen viral. En peces, se ha demostrado la existencia de moléculas y genes de CMH tipo I (Fischer y col., 2013), por lo que cabe suponer que pueden ejercer una respuesta inmune celular similar a vertebrados superiores. Para el caso de los linfocitos T en peces, la identificación de secuencias homólogas al receptor TCR, y a algunas cadenas del complejo CD3, indica la presencia de estas células inmunes en teleósteos (Figura 2). De este modo, las células citotóxicas reconocen estos péptidos extraños y se encargan de destruir a las células que los presentan (Imarai, 2008). Inmunoglobinas En mamíferos, se han identificado cinco isotipos de inmunoglobulinas IgM, IgD, IgG, IgE, IgA los cuales poseen funciones efectoras específicas en la respuesta inmune celular y humoral (Flajnik y Kasahara, 2010). Los peces teleósteos son los vertebrados óseos más primitivos que contienen inmunoglobulinas y que, al contrario de mamíferos y aves, están desprovistos de IgA o un equivalente funcional de IgA. Hasta hace poco, se creía que los peces teleósteos contenían sólo dos clases de inmunoglobulinas, IgM e IgD, y también se aceptó que generalmente IgM era la inmunoglobulina que se encontraba tanto en los compartimentos sistémicos como en mucosas. Sin embargo, en el año 2005 se describe el gen de la IgT en trucha (Danilova y col., 2005) o IgZ en pez cebra (Hu y col., 2010) la que representaría la última clase de inmunoglobulina que se encuentra en las especies de los vertebrados (Flajnik y Kasahara, 2010), donde IgT en trucha arcoíris sería una inmunoglobulina intestinal, especializada en respuestas inmunitarias de las mucosas, mientras IgM parece estar especializada en la inmunidad sistémica (Zhang y col., 2010).
Respuesta inmune contra P. salmonis Uno de los primeros pasos para el reconocimiento de los patógenos por parte del sistema inmune innato es la interacción de PAMPs de P. salmonis con receptores de tipo Toll. En estudios realizados por Salazar y col., (2015), se evaluó la cinética de expresión de receptores tipo Toll durante la infección por P. salmonis en células SHK-1. Debido al hecho de que P. salmonis es un patógeno bacteriano, posee PAMPs que pueden ser reconocidos por los TLRs. Por ejemplo, P. salmonis es una bacteria Gram-negativa que contiene lípidos, proteínas e hidratos de carbonos en su membrana que podrían ser reconocidos por TLR1 y TLR22. Esta bacteria también se ha descrito por tener algunos tipos de flagelina en su membrana externa y las que podrían ser reconocidas por TLR5M y TLR5S. Además, TLR9 es capaz de reconocer CpG-DNA no metilado, que es característica para el genoma de la bacteria (Salazar y col., 2015). En particular, se determinó que durante la infección in vitro de P. salmonis no se observa una alta expresión de TLR5M y TLR5S, aún cuando la bacteria presenta flagelina en su membrana. En conclusión, la infección por P. salmonis modula la expresión de TLR1, TLR22, TLR5M, TLR5S y TLR9 así como la expresión de IL-1β en la línea celular de riñón SHK-1. A su vez, como se observa en la mayoría de los estudios cinéticos de activación de diferentes TLRs, P. salmonis desencadenaría una cascada de señalización mediada por TLRs que termina con la activación de diferentes citoquinas, tales como IL-1β (Salazar y col., 2015). Sin embargo, debemos hacer notar que las modulaciones diferenciadas de expresión registrados para los TLRs estudiados, son apoyados por el hecho que las células del sistema inmune utilizan múltiples TLRs para detectar varias características de un patógeno de forma simultánea (Underhill y Ozinsky, 2002) A nivel in vivo, la genómica funcional aplicada a la respuesta inmune contra P. salmonis se han estudiado en tres tejidos diferentes, como son riñón anterior, hígado y músculo, luego de 48 horas post infección. En el riñón anterior, se observó el mayor aumento de expresión de genes relacionados con respuestas de tipo inflamatoria, siendo los principales marcadores afectados el mRNA de TNF-α 1 y 2, IL-8, varias quimioquinas y sus receptores. En el caso de TNF-α, es una citoquina proinflamatoria producida por monocitos/macrófagos en respuesta a la exposición a antígenos. Además, las quimiocinas como CCL13, CXCR3, y IL-8, son pequeñas citoquinas secretadas y que juegan un papel esencial en la inflamación, controlando la atracción de leucocitos a sitios de infección e injuria. De hecho, IL-8 es producida por los macrófagos en respuesta a una variedad de estímulos (LPS, virus, citoquinas), y en peces salmónidos, se ha demostrado que es regulada en muchos modelos de infección. Más aún, la infección con P. salmonis también induce la regulación de la expresión de IFN-γ. IFN-γ activa los macrófagos, mejora la presentación de antígenos, e induce la diferenciación de células T. Y lo más importante, coordina la defensa del hospedero contra patógenos intracelulares. También estimula los macrófagos para producir especies reactivas del oxigeno y del nitrógeno, que tiene un efecto bactericida en bacterias intracelulares. Es importante mencionar que también se observó una disminución de la expresión de IL-10, la cual está asociada a menudo con la reducción de la inflamación, como una manera de reducir el daño del tejido infectado. En general, también se detectó un aumento de la expresión de genes de inmunidad innata en músculo e hígado, lo que potencialmente pudo inducir respuestas inflamatorias en la porción anterior del riñón y una respuesta mediada por IFN en el hígado. Sin embargo, tanto en riñón anterior, hígado y músculo se observó una disminución de los mRNAs relacionados con funciones inmunes adaptativas celulares y humorales como el receptor TCR y el receptor de IL-4. En el caso de TCRα y β, forman del receptor TCR, responsable de reconocer antígenos unidos al complejo mayor de MHCI y en el caso del receptor de IL-4, está relacionado con el control de la actividad de IL-4, un regulador clave en la inmunidad adaptativa humoral y secretada por linfocitos T activados, basófilos y mastocitos. Todo lo anterior sugiere que la bacteria disminuye estas respuestas en etapas tempranas de la infección, como un mecanismo para escapar de las defensas del hospedero (Tachi y col., 2011). Lo anterior es apoyado por observaciones que mencionan que P. salmonis pueden vivir y replicarse dentro de la célula hospedera, escapando a la respuesta inmune desarrollada contra la bacteria (McCarthy y col., 2008). En su conjunto, la respuesta inmune a nivel transcripcional frente a la infección con P. salmonis demuestra, tanto in vitro como in vivo, que células inmunes y el riñón anterior despliegan todo su “arsenal de armas” a nivel innato para combatir a la bacteria, tanto a través de sus mecanismos de reconocimiento bacteriano y activación celular (Tachi y col., 2011; Salazar y col., 2015). Respecto de la respuesta específica humoral, tanto la expresión génica como los niveles proteicos de IgT comienzan a aumentar a los días 21, 28 y 35 post-desafío en intestino, riñón y bazo de trucha arcoíris (Oncorhynchus mykiss) infectadas con P. salmonis. En cuanto a IgM se pudo observar una mayor expresión génica en riñón anterior, bazo e intestino a los días 14, 21 y 28 post-desafío. En el caso de los títulos de IgM e IgT en suero, estas inmunoglobulinas anti-P. salmonis fueron detectadas por Eisa, mostrando un aumento significativo desde el día 14 y 21 post desafío, respectivamente. Asimismo, a nivel innato, concomitante al estudio de IgT e IgM, se observó un aumento de la expresión génica de IL-8 e IL-1β en riñón anterior en el día 14, en bazo el día 21, y en intestino a los días 3 y 7 post-desafío. Estos resultados demuestran que hay una respuesta de los distintos componentes del sistema inmune innato y adquirido durante la infección con P. salmonis, y aunque es diferenciada en el tiempo, deberían interactuar juntas para enfrentar la infección de la bacteria (Nualart, 2015). P. salmonis tiene la capacidad de regular hacia abajo la expresión de determinados genes relevantes en la inmunidad celular específica en riñón anterior, como es el caso de receptores de linfocitos T, tales como TCR-alpha, TCR-Beta y CD8. Esta capacidad del patógeno le permite regular hacia abajo la activación de los linfocitos, células efectoras frente a patógenos intracelulares, como es el caso de P. salmonis (Tacchi y col., 2011). Por lo que, inmunoestimulantes que permitan modular hacia arriba la expresión de estos genes, podrían jugar un rol relevante en la protección frente a este patógeno.
Agradecimientos Maquinewlife S.A.; Proyecto Corfo 12ETN-18828; Proyecto Fondecyt 1141006; Proyecto Fondap 15110027
Referencias Alvarez-Pellitero P. (2008). Fish immunity and parasite infections: From innate immunity to immunoprophylactic prospects. Veterinary Immunology and immunopathology 126: 171–198. Bassity E, Clark TG. (2012) Functional identification of dendritic cells in the teleost model, rainbow trout (Oncorhynchus mykiss). PLoS One 7(3):e33196. Bernstein, R.M., S.F. Schluter, J.J. Marchalonis (1998). Immunity. En: The physiology of fishes. D.H. Evans. 2ª ed. CRC Press LLC. USA. 215-242. Danilova N., Bussmann J., Jekosch K., Steiner L.A. (2005): The immunoglobulin heavy-chain locus in zebrafish: identification and expression of a previously unknown isotype, immunoglobulin Zeitschrift fur Nature Immunology, 6, 295–302. Evans D.L., Jaso-Friedmann L. (1999) Nonspecific cytotoxic cellsand innate cellular immunity in teleost fish. In: Fingerman M, Nagabhushanam R. (eds) Recent advances in marine biotechnology, Vol 5. Science Publishers, Enfield, pp 243-268. Fischer U, Koppang EO, Nakanishi T. (2013) Teleost T and NK cell immunity. Fish Shellfish Immunol.35(2):197-206. Flajnik MF, Kasahara M. (2010) Origin and evolution of the adaptive immune system: genetic events and selective pressures. Nat. Rev. Genet. ;11:47–59. Fryer J. y Hedrick R. (2003). Piscirickettsia salmonis: a Gram negative intracellular bacterial pathogen of fish. Journal of Fish Diseases 26, 251-262. Graves S.S., Evans D.L., Dawe D.L (1985) Antiprotozoan activity of nonspecific cytotoxic cells (NCC) from the channel catfish (Ictalurus punctatus). J Inmunol 134:78-85. Grimholt, U., I. Hordvik, V.M. Fosse, I. Olsaker, C. Endrese, y Ø. Lie (1993). Molecular cloning of major histocompatibility complex class I cDNAs from Atlantic salmon (Salmo salar). Immunogenetics, 37:469-473. Harris D., Jaso-Friedmann L., Devlin R., Koren H., Evans D. (1991). Identification of an evolutionarily conserved, function-associated molecule on human natural killer cells. Proc. Natl. Acad. Sci. 88:3009-3013. Hu Yu-Lan, Xianga L., Zhong J. (2010). Identification and characterization of a novel immunoglobulin Z isotype in zebrafish: Implications for a distinct B cell receptor in lower vertebrates. Molecular Immunology Volume 47, Issue 4, January 2010, Pages 738–746 Imarai M. (2008). “Un nuevo desafío para la acuicultura”. Contribuciones científicas y tecnológicas. Universidad de Santiago de Chile, Chile. 135: 37-44. Jaso-Friedmann L., Leary J., Evans D. (2001). The non-specific cytotoxic cell receptor (NCCRP-1): molecular organization and signaling properties. Dev. & Com. Inmunol. 25: 701-711. McCarthy U., Bron J., Brown L., Pourahmad F., Bricknell I., Thompson K., Adams A. & Ellis A. (2008). Survival and replication of Piscirickettsia salmonis in rainbow trout head kidney macrophages. Fish and Shellfish Immunology 25, 477-484. Rajalingam , R. 2011. Human diversity of killer cell immunoglobulin-like receptors and disease. Korean J Hematol. 2011 Dec;46(4):216-228. Rise M. L., Jones S.R., Brown G. D., Von Schalburg K. R., Davidson W. S., Koop B. F. (2004). Microarray analyses identify molecular biomarkers of Atlantic salmon macrophage and hematopoietic kidney response to Piscirickettsia salmonis infection. Physiological Genomics Published. 20 (1) 25-30. Rubio-Godoya M. (2010).Inmunología de los peces óseos. SIÓN Rev Mex Cienc Pecu 2010; 1 (1): 47-57 Salazar C., Haussmann D., Kausel G. and Figueroa J. (2015). Molecular cloning of Salmo salar Toll-like receptors (TLR1, TLR22, TLR5M and TLR5S) and expression analysis in SHK-1 cells during Piscirickettsia salmonis infection. Journal of Fish Diseases 1-10. Stevenson, R.M.W., B. Raymond (1990). Delayed-type hypersensitivity skin reactions. En: Techniques in fish immunology. FITC-1. J.S. Stolen, T.C. Fletcher, D.P. Anderson, B.S. Roberson y W.B. Muiswinkel. SOS Publications. Fair Haven, New Jersey. USA. 173-178. Tachi L., Bron J.E., Taggart J.B., Secombes C.J., Bickerdike R., Adler M.A., Takle H. and Martin A.M. (2011) Multiple tissue transcriptomic responses to Piscirickettsia salmonis in Atlantic salmon (Salmo salar). Physiol Genomics 43: 1241-1254. Tort L., Balasch J. C., Mackenzie S. (2003). Fish immune system. A crossroads between innate and adaptive responses. Inmunología. Universidad Autónoma de Barcelona, España. 22: 277-286. Trischitta F., Takei Y., Sébert P. (2014). Eel physiology. (Pp 310-311). CRC Press, Florida, Estados Unidos. Underhill D. y Ozinsky A. (2002) Toll-like receptors: key mediators of microbe detection. Current opinion in Immunology 14, 103-110. Zapata A. (1985). Inmunología de peces teleósteos. En: Primer curso teórico-práctico sobre acuicultura. Ministerio de Agricultura, Pesca y Alimentación. Madrid. 123-205. Zhang YA1, Salinas I, Li J, Parra D, Bjork S, Xu Z, LaPatra SE, Bartholomew J, Sunyer JO. (2010) IgT, a primitive immunoglobulin class specialized in mucosal immunity. Nat Immunol. 11(9):827-35. Zou J., Carrington A., Collet B., Dijkstra J. M., Yoshiura Y., Bols N., Secombes C. (2005). Identification and Bioactivities of IFN-y in Rainbow Trout Oncorhynchus mykiss: The First Th1-type cytokine characterized functionally in fish. The journal of immunology. 175: 2484-2494.
















