Desarrollo de kits de Elisa para la evaluación y determinación de la calidad de las vacunas comerciales contra Piscirickettsiosis utilizadas por la industria salmonicultora
Alejandro Yáñez1,3; Daniela Nualart1; Rodrigo Sandoval1; Hugo Silva1,5; Cristian Oliver1,3; Ruben Avendaño-Herrera2,3; Jorge Mancilla Sch.4,5; Alex Romero3; Jaime Figueroa1,3; Juan G. Cárcamo1,3 1 Instituto de Bioquímica y Microbiología, Facultad de Ciencias, Universidad Austral de Chile. 2 Laboratorio de Patología de Organismos Acuáticos y Biotecnología Acuícola, Facultad de Ciencias Biológicas, Universidad Andrés Bello. 3 Interdisciplinary Center for Aquaculture Research, Fondap-Incar. 4 Marine Harvest Chile. 5 Programa de Doctorado en Ciencias de la Acuicultura, Universidad Austral de Chile.
Generalidades La industria salmonicultora se ha convertido en uno de los sectores más exitosos y productivos de la economía nacional. Esta producción se lleva a cabo principalmente en las regiones del sur de Chile, siendo dominada por el cultivo de salmón Atlántico (Salmo salar), salmón Coho (Oncorhynchus kisutch) y trucha arcoíris (Oncorhynchus mykiss). El carácter intensivo de estos cultivos, junto con los altos niveles de producción, han permitido la aparición de una serie de patologías que generan considerables pérdidas por mortalidad y, por consiguiente, un fuerte impacto en la sustentabilidad económica de la industria. Dentro de ellas, la Piscirickettsiosis es la enfermedad infecto-contagiosa que genera las más altas mortalidades en especies salmónidas y millonarias pérdidas económicas en el sector. El primer brote fue descrito por Bravo y Campos en 1989 en salmones Coho cultivados en su fase de agua de mar. Aunque inicialmente se postuló que sólo el salmón Coho era susceptible, prontamente infecciones naturales dieron lugar a altos niveles de mortalidad en salmón Atlántico, salmón Chinook (Oncorhynchus tshawytscha) y trucha arcoíris (Garcés y col., 1991; Cvitanich y col., 1991). El agente etiológico de la enfermedad recibió el nombre de Piscirickettsia salmonis y, a pesar de que los principales hospederos de esta bacteria Gram-negativa son peces de los géneros Oncorhynchus y Salmo de la subfamilia Salmoninae. P. salmonis ha sido encontrada en otras especies de peces como en “sea bass” europeo (Dicentrarchus labrax), los cuales eran cultivados en el mar Mediterráneo en las costas de Grecia y donde la presencia de P. salmonis se determinó mediante análisis serológicos, histológicos y genómicos de muestras de tejidos de peces infectados (McCarthy y col. 2005). Posteriormente, se reportó la presencia de P. salmonis en “sea bass” blanco (Atractoscion nobilis) juveniles cultivados en estanques con agua de mar en California (Estados Unidos) (Arkush y col. 2006). Del mismo modo, se ha reportado P. salmonis en las costas de Irlanda (Rodger y Drinan, 1993), Noruega (Olsen y col. 1997) y Escocia (Birrell y col. 2003).
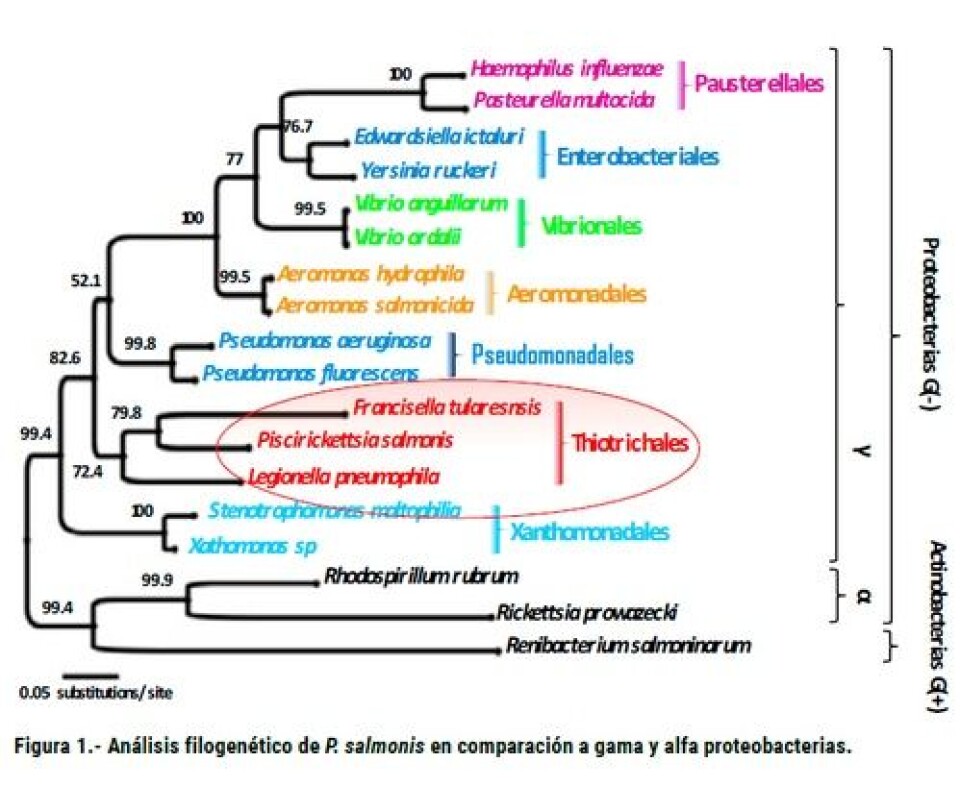
Sin embargo, actualmente los brotes más importantes de esta patología ocurren en los centros de engorda del sur de Chile, los cuales en el año 2013 ocasionaron mortalidades del 94,6%, 69,4% y 60,3% en trucha arcoíris, salmón Atlántico y salmón Coho, respectivamente (Sernapesca, 2013). El patógeno aislado desde los peces infectados fue inicialmente identificado como una bacteria intracelular similar a rickettsia y la patología fue erróneamente denominada Síndrome Rickettsial del Salmón (SRS). Este error se debió a la principal característica intracelular de la bacteria y a los síntomas similares que tiene a la infección de organismos tipo rickettsial (RLO). Sin embargo, estudios genómicos usando la información génica del ADNr 16S de esta bacteria mostraron que el microorganismo constituía su propio grupo taxonómico, el que fue denominado Piscirickettsia salmonis gen. nov., sp. nov.. Estudios genómicos más recientes permitieron establecer que esta bacteria está estrechamente relacionada con otras bacterias intracelulares que afectan a humanos, y que pertenecen a los géneros Francisella, Legionella y Coxiella (Figura 1). Cabe destacar que las especies de Rickettsia pertenecen a la clase de las alfa proteobacterias, clase totalmente alejada de Piscirickettsia que pertenece a la clase gamma proteobacterias. Por ello, en una publicación previa, proponemos corregir el nombre y la denominación de esta patología donde se restablezca: 1.- la característica amplia de infección de salmonideos; 2.- la correcta filogenia de la bacteria y 3.- el cuadro patológico, eliminando la característica de síndrome ya que se conoce al agente que produce una septicemia. Así, creemos que la denominación más correcta sería “Septicemia Piscirickettsial de Salmónidos (SRS)”. El agente etiológico de la Piscirickettsiosis mostró que en el proceso infeccioso producía esplenomegalia en diferentes grados. Internamente, el análisis macroscópico de los órganos de peces infectados permite evidenciar diferentes grados de ascitis y de peritonitis (Branson y Nieto Díaz-Muñoz, 1991), así como hemorragias petequiales en estómago, intestino, ciegos pilóricos, vejiga natatoria, grasa visceral (Cvitanich y col., 1991), musculatura abdominal (Larenas y col., 1995) y peritoneo (Branson y Nieto Díaz-Muñoz, 1991). El hígado de estos peces infectados se observa pálido y hemorrágico, presentando un considerable aumento de tamaño (Branson y Nieto Díaz-Muñoz, 1991) y pequeños nódulos subcapsulares blanquecinos a amarillentos en toda su superficie (Figura 2) (Larenas y col., 1995; Olsen y col., 1997). Además, la mayoría de los peces muestra un riñón aumentado de tamaño y exhibe pérdida de su apariencia brillante, presentándose de color café-grisáceo opaco (Alvarado y col., 1990; Fryer y col., 1990; Branson y Nieto Díaz-Muñoz, 1991).
Prevención y control Para la mayoría de las enfermedades infecto contagiosas que afectan a peces de cultivo, existe un conjunto de medidas de manejo que se recomiendan poner en práctica, tal es el caso para la prevención y control de la Piscirickettsiosis (OlE, 2000; Yuksel y col., 2006a; Olson y Criddle, 2008). En este sentido, algunas de las medidas que se recomiendan son: i) desinfectar la superficie de las ovas con yodóforos (Fryer y Hedrick, 2003), ii) seleccionar familias de peces que hayan demostrado mayor resistencia a brotes y menor mortalidad (Cassigoli, 1994), iii) disminuir la manipulación de los peces (vacunaciones, cambios de redes, tratamientos inyectables, etc.) para aminorar el estrés (Bravo y Campos, 1989b; Bravo y Gutiérrez, 1991; Larenas y col. 2000; Leal y Woywood, 2007), iv) mantener bajas densidades de biomasa por balsa-jaula, por centro y por área geográfica (Cassigoli, 1994; Olson y Criddle, 2008), v) trasladar los smolts directamente desde agua dulce a salada, sin pasar por estuarios (Leal y Woywood, 2007), vi) extraer rápidamente los peces enfermos y muertos desde las balsas-jaulas (Cassigoli, 1994; Almendras y col., 1997; Larenas, 1999), vii) fomentar el descanso sanitario de los centros previo al ingreso de nuevos peces (Cassigoli, 1994; Fryer y Hedrick, 2003) y, viii) mantener limpias las redes de las balsas-jaulas (Olson y Criddle, 2008).
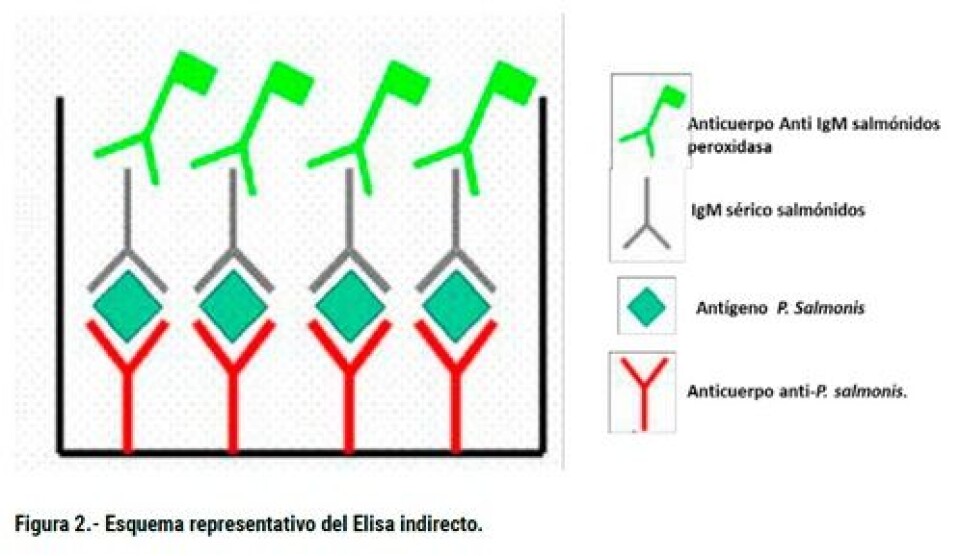
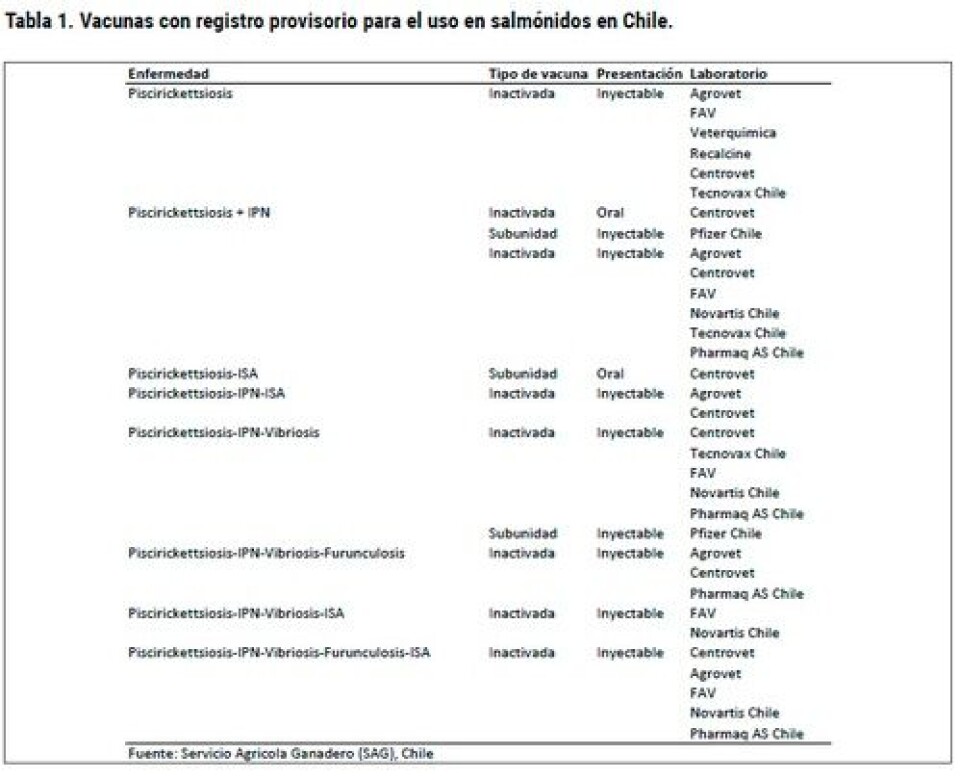
La cepa mejor caracterizada bioquímica y molecularmente de P. salmonis es la cepa tipo denominada con la sigla LF-89 (Mauel y Miller, 2002), la cual se encuentra depositada en la American Type Culture Collection como ATCC VR 1361 (Fryer y col., 1990). Recientemente, nuestro grupo de investigación ha estudiado otra cepa proveniente de un brote, aportando con la secuenciación del genoma de esta cepa altamente patogénica de P. salmonis denominada Austral-005 (Yañez y col., 2014). El análisis del genoma ha permitido la identificación de variados genes implicados en la patogenicidad, adaptación al medio ambiente, vías metabólicas, elementos transponibles y secuencias de inserción. Así, los análisis bioinformáticos corroboraron nuestras publicaciones donde mostrábamos que el hierro es un factor altamente conservado y esencial para el crecimiento de P. salmonis (Yáñez y col., 2012; 2013; 2014a, b). En tanto, también se detectó que existe una falta de enzimas que participan en la biosíntesis de las vías catabólicas de cisteína, la cual permite comprender porque P. salmonis requiere este aminoácido como fuente de azufre. Asimismo, los factores de virulencia presentes en el genoma de P. salmonis indican que esta bacteria está equipada con un conjunto de genes que facilitan su supervivencia en condiciones ambientales desfavorables encontradas en el hospedero. Todos ellos pueden ser objetivos potenciales para el diseño de fármacos y vacunas. En este mismo sentido, la secuencia genómica de este importante patógeno de salmónidos ha provisto un marco de trabajo para el desarrollo de herramientas biotecnológicas que han favorecido el manejo de P. salmonis en condiciones de laboratorio, el desarrollo de métodos de diagnóstico temprano, y nuevas estrategias para la prevención y control de la enfermedad. Cabe destacar que el desarrollo de vacunas para P. salmonis ha sido complejo, prueba de esto es que las investigaciones para el desarrollo de una vacuna contra P. salmonis se inició a mediados de la década de los noventa por los principales laboratorios productores de vacuna en el mundo. Sin embargo, la eficacia de estas vacunas en condiciones de campo no han mostrado los resultados esperados, siendo la incidencia actual de la patología cercana al 77% en trucha arcoíris y de un 80% en salmón Atlántico. Por lo tanto, basados en la masividad de vacunación de salmonídeos, los distintos tipos de formas de vacunas presentes en la salmonicultura y sus distintas tasas de protección existe una oportunidad de negocio, pero se requiere del estudio de cada formulación. En el mercado existen actualmente cinco vacunas especificas contra P. salmonis y otras 15 que son bivalentes, trivalentes y cuádruples, que además del SRS sirven para prevenir la Necrosis Pancreática Infecciosa (IPN), vibriosis, furunculosis y Anemia Infecciosa del Salmón (ISA) (Fuente: SAG; Tabla 1). Desafortunadamente, en la actualidad no existen en el mercado kit de diagnósticos validados que permitan con alta sensibilidad, especificidad y reproductibilidad, evaluar la eficacia de las vacunas utilizadas por la industria. Este problema genera la oportunidad y necesidad urgente de desarrollar kit diagnósticos que permitan no sólo evaluar la eficacia sino también el tiempo de protección de las vacunas. Es interesante señalar que, actualmente, estos estudios se realizan en los mismos laboratorios farmacéuticos que generan y producen las vacunas en sus distintas formulaciones. Por ello, en nuestro laboratorio de investigación, el cual es parte del Centro Fondap Incar nos planteamos el desarrollo de kits diagnósticos basados en la técnica del Elisa (Enzime-Linked ImmunoSorbent Assay), que permitan determinar y evaluar en forma específica y confiable la eficacia de las vacunas que son utilizadas en los centros productivos de salmónidos para la prevención de la infección por P. salmonis, permitiéndole al productor tomar decisiones de compra y tipos de esquemas de vacunación con datos científicos validados en terreno. Para ello, se diseñó, implementó y validó un sistema de Elisa específico para la evaluación de anticuerpos séricos en peces contra la bacteria P. salmonis. Este inmuno-ensayo se fundamentó en la detección de antígenos en una fase solida mediante la utilización de anticuerpos específicos que pueden ser medidos directa o indirectamente por una reacción enzimática. Este método es muy versátil, robusto, sensible y simple. De esta forma, se desarrollaron dos clases de kits, uno para la cuantificación de anticuerpos específicos para P. salmonis usando un Elisa clásico y otro fluorescente. Inicialmente, a partir de aislados de P. salmonis obtenidos en centros productivos chilenos, se purificaron proteínas que permitieron producir anticuerpos poli y monoclonales específicos, los que combinados (proteínas de patógenos/anticuerpos específicos) nos permitieron generar kits de diagnóstico inmunológicos (Elisa y sero-neutralización) de alta sensibilidad (kit fluorescente) y especificidad para analizar la respuesta inmune humoral de los peces vacunados. Con estas herramientas biotecnológicas es posible determinar la calidad de las vacunas que se ofrecen al productor y facilitar la toma de decisión productiva sobre qué vacuna emplear, basado en un amplio conocimiento biotecnológico. Otro aspecto importante de un kit de diagnóstico de enfermedades es la especificidad, es decir, la capacidad de discriminar exclusivamente la presencia de un patógeno por sobre otros patógenos acuícolas. Si nos limitamos al grupo de patógenos bacterianos que afectan salmonídeos, nos daremos cuenta que comparten similitud en una amplia gama de sus proteínas constituyentes y, por ende, las inmunoglobulinas producidas por el hospedero frente a la infección pueden reconocer proteínas homologas de dos tipos distintos de patógenos. Por lo tanto, la especificidad del kit fue un gran logro del equipo de trabajo. Aunque el método de inmuno-diagnóstico acoplado a un sistema de revelado por fluorescencia puede ser bastante atractivo, en nuestro estudio no representó grandes diferencias en el sentido práctico de aumentar significativamente la sensibilidad del método diagnóstico. A su vez, la falta de detectores fluorescentes en la industria también es un problema que debilita el desarrollo de un kit más sensible fluorescente. Esto sumado a que el kit desarrollado con técnicas convencionales con sustratos cromogénicos mostró un rango dinámico amplio y capaz de detectar diferencias en la inducción de IgM en sueros de peces vacunados después de 300 y 600 Unidades Térmicas Acumuladas (UTAs) (Figura 3; color azul). Creemos que este punto es vital para cuantificar pequeñas cantidades de IgM específica y generadas al inicio de programas de vacunación, así como para determinar las diferencias en la inducción humoral de las distintas vacunas del mercado.
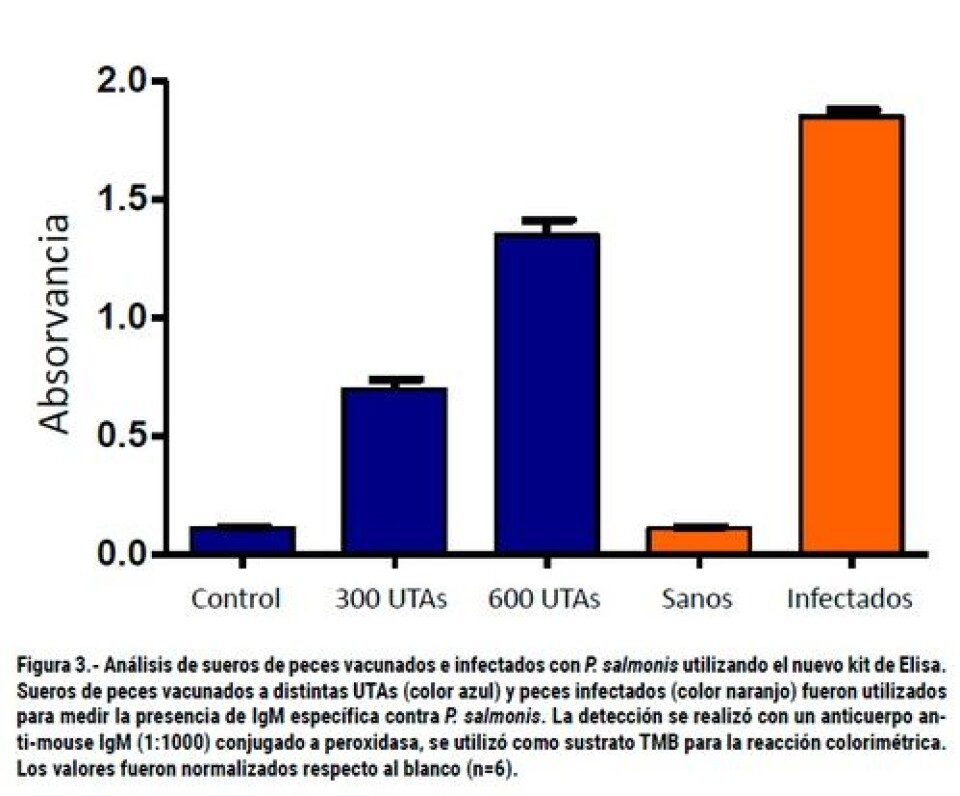
En resumen, el desarrollo de nuestro método de Elisa permitirá su utilización para evaluar la respuesta inmune humoral de peces vacunados contra P. salmonis y también tiene la posibilidad de ser utilizado como sistema de diagnóstico complementario de los resultados de laboratorio basados principalmente en RT-qPCR. En la Figura 3 se muestran los resultados del Elisa en una jaula que evidenciaba altas mortalidades asociadas con Piscirickettsiosis, demostrando la capacidad diagnóstica del kit (color naranjo). Cabe mencionar que esta estrategia es ampliamente utilizada en humanos para la evaluación de vacunas y para confirmación de infección por patógenos virales y bacterianos, por lo que esta técnica podrá ser adoptada por la mayoría de los laboratorios de diagnóstico de enfermedades acuícolas de la zona sur austral. Además, la utilización de estas herramientas en forma independiente, será de gran valor diagnóstico y muy útil para los productores y médicos veterinarios dedicados a la salmonicultura. Por lo tanto, esperamos que este sistema genere en el mediano plazo una matriz de datos más confiables sobre la eficacia de vacunas, que dará mayor versatilidad al laboratorio de diagnóstico y tranquilidad al productor de salmones como a los fiscalizadores nacionales. Financiado por: “Interdisciplinary Center for Aquaculture Research (Incar)”. Fondap, Nº15110027 y INNOVA-CHILE 11IDL2 – 10523.
Referencias Almendras FE, SRM Jones, IC Fuentealba, GM Wright. 1997. In vitro infection of a cell line from Ictalurus nebulosus with Piscirickettsia salmonis. Can J Vet Res 6, 66-68. Alvarado V, JW Schäfer, R Enríquez, M Monrás, V Cubillos, C Farías, A Alberdi. 1990a. Nueva enfermedad del salmón Coho (Oncorhynchus kisutch) cultivado en fase de agua de mar en Chile. Situación actual. En: VIII Congreso de Med. Vet., octubre de 1990. Valdivia, Chile. 128p. Arkush KD, AM McBride, HL Mendonca, MS Okihiro, KB Andree, S Marshall, V Henríquez, RP Hedrick. 2005. Genetic characterization and experimental pathogenesis of Piscirickettsia salmonis isolated from white seabass Astractoscion nobilis. Dis Aquat Org 63, 139-149. Birrell J, S Mitchell, DW Bruno. 2003. Piscirickettsia salmonis in farmed Atlantic salmon, Salmo salar in Scotland. Bull Eur Assoc Fish Pathol 23, 213-218. Branson EJ, D Nieto-Diaz-Munoz.. 1991. Description of a new disease condition occurring in farmed Coho salmon, Oncorhynchus kisutch, (Walbaum), in South America. J Fish Dis 14, 147-156. Bravo S, M Campos. 1989. Síndrome del Salmón Coho. Chile Pesquero, 54, 47-48. Bravo S, YS Gutiérrez. 1991. Avances en el estudio del Síndrome del salmón Coho. Chile Pesquero 61, 39-42. Cassigoli J. 1994. Patología y nutrición en el desarrollo de la acuicultura: Factores de exito. En: Resúmenes de Seminario de Patología y nutrición en el desarrollo de la acuicultura: Factores de éxito. Fundación Chile, Puerto Montt, Chile. pp. 52-55. Cvitanich JD, NO Garate, CE Smith. 1991. The isolation of a rickettsia-like organism causing disease and mortality in Chilean salmonids and its confirmation by Koch’s postulate. J Fish Dis 14, 121-145 Fryer JL, CN Lannan, HL Garcés, JJ Larenas, PA Smith. 1990. Isolation of a rickettsial-like organism from diseased Coho salmon (Oncorhynchus kisutch) in Chile. Fish Pathol. 25, 107-114. Fryer JL, RP Hedrick. 2003. Piscirickettsia salmonis: a Gram-negative intracellular bacterial pathogen of fish. J Fish Dis 26, 251-262. Garcés LH, JJ Larenas, PA Smith, S Sandino, CN Lannan, JL Fryer. 1991. Infectivity of a rickettsia isolated from Coho salmon Oncorhynchus kisutch. Dis Aquat Org 11, 93-97. Larenas JJ, L Hidalgo, H Garcés, JL Fryer, PA Smith. 1995. Piscirickettsiosis: Lesiones en salmón del Atlántico (Salmo salar) infectados naturalmente con Piscirickettsia salmonis. Av Cienc Vet 10, 53-58. Leal J, D Woywood. 2007. Piscirickettsiosis en Chile: Avances y perspectivas para su control. SalmoCiencia 2, 34-42. Mauel MJ, SJ Giovannoni, JL Fryer. 1996. Development of polymerase chain reaction assays for detection and differentiation of Piscirickettsia salmonis. Dis Aquat Org 26: 189-195. McCarthy U, NA Steiropoulos, KD Thompson, A Adams, AE Ellis, HW Ferguson. 2005. Confirmation of Piscirickettsia salmonis as a pathogen in European sea bass Dicentrarchus labrax and phylogenetic comparison with salmonid strains. Dis Aquat Org 64, 107-119. Olsen AB, HP Melby, L Speilberg, O Evensen, T Hastein. 1997. Piscirickettsia salmonis infection in Atlantic salmon Salmo salar in Norway-epidemiological, pathological and microbiological findings. Dis Aquat Org 31, 35-48. Olson T, KR Criddle K..2008. Industrial evolution: a case study of Chilean salmon aquaculture. Aquaculture Economics and Management 12, 1-18. Rodger HD, EM Drinan. 1993. Observation of a rickettsia like organism in Atlantic salmon, Salmo salar L., in Ireland. J Fish Dis 16, 361-369. Yañez AJ, C Molina, RE Haro , P Sanchez, A Isla, J Mendoza, M Rojas-Herrera, A Trombert, AX Silva, JG Cárcamo, J Figueroa, V Polanco, P Manque, V Maracaja-Coutinho, VH Olavarría. 2014a. Draft genome sequence of virulent strain Austral-005 of Piscirickettsia salmonis, the etiological agent of piscirickettsiosis. Genome Announcements. 16, 5 pii: e00990-14. Yáñez AJ, K Valenzuela, C Matzner, V Olavarría, J Figueroa, R Avendaño-Herrera, JG, Carcamo. 2014b. Broth microdilution protocol for minimum inhibitory concentration (MIC) determinations of the intracellular salmonid pathogen Piscirickettsia salmonis to florfenicol and oxytetracycline. J Fish Dis. 37, 505-509. Yáñez AJ, H Silva, K Valenzuela, JP Pontigo, M Godoy, J Troncoso, A Romero, J Figueroa, JG Carcamo, R Avendaño-Herrera. 2013. Two novel blood-free solid media for the culture of the salmonid pathogen Piscirickettsia salmonis. J Fish Dis. 36, 587-591. Yáñez AJ, K Valenzuela, H Silva, J Retamales, A Romero, R Enriquez, J Figueroa, A Claude, R Avendaño-Herrera, JG Carcamo. 2012. A broth medium for the successful culture of the fish pathogen Piscirickettsia salmonis. Dis Aquat Org 97, 197-205.




















