Acuicultura y Floraciones de Algas Nocivas (FAN): ¿Un efecto Ambiental Incierto de la Salmonicultura en Chile?
Dr. Rodrigo Vera S. División de acuicultura, Departamento de Medio ambiente Instituto de Fomento Pesquero

Introducción El fitoplancton forma la base de la cadena alimenticia acuática existiendo aproximadamente 4000 especies marinas (Sournia, 1995), la mayoría de las cuales son inofensivas para el hombre. Sin embargo unas pocas pueden ser peligrosas debido a que producen naturalmente una variedad de biotoxinas que afectan la salud humana, causando indirectamente además, pérdidas económicas a través de impactos negativos en los servicios ecosistémicos (Davidson y col., 2014). Por otra parte, debe hacerse una distinción entre las especies nocivas de fitoplancton, las con alta biomasa y especies con baja biomasa. Las floraciones con alta biomasa fitoplanctónica generalmente resultan en una baja de las concentraciones de oxígeno disuelto en la columna de agua cuando el floramiento decanta y es descompuesto por las bacterias. En tanto, los cultivos de salmónidos pueden verse afectados debido a un efecto densodependiente del fitoplancton, donde la saturación de mucus y/o abrasión en las branquias, aumentan drásticamente las tasas de mortalidad de peces (Bruno y col., 1989). Por otro lado, el floramiento de especies tóxicas de baja biomasa actúan por medio de la producción de biotoxinas, que por medio de su concentración en organismos filtradores pueden ser transferidos a la cadena alimenticia y llegar a ser peligrosos para la salud humana (Davidson y col., 2011).
Efecto antropogénico Es conocido a nivel mundial, que los procesos naturales de eutrofización son acelerados por la actividad antropogénica y pueden alterar los ciclo biogeoquímicos de los nutrientes (Li y col., 2011). Aunque la relación entre nutrientes y producción fitoplanctónica es relativamente clara en muchos lugares, los factores que afectan directamente a las fuentes de nutrientes, composición y su limitación en cuerpos de agua pueden ser muy variados, y cuando determinadas condiciones se hacen presentes en la columna de agua, estas pueden resultar en una excesiva producción de fitoplancton (Guilford y Hecky, 2000) gatillando un Floramiento Algal Nocivo (FAN, fenómenos conocidos como mareas rojas) (Fig. 1). Determinar las causas de un FAN es complejo. Mientras que el transporte de células por el agua y el cambio climático son potencialmente importantes en la biogeografía y formación de FAN, es generalmente aceptado que la viabilidad de nutrientes disueltos en la columna de agua influye en el crecimiento del fitoplancton en la mayoría de las aguas costeras. Como consecuencia de esto, si se incrementa la población humana de las zonas costeras, la industrialización y la intensificación de la agricultura elevan el suplemento de nitrógeno y fósforo (Ferreira y col., 2011) en primera instancia en aguas continentales como ríos y lagos, los que posteriormente desembocan en aguas costeras y marinas. El rol del enriquecimiento de nutrientes por efecto antropogénico y los cambios en la relación de concentración de nutrientes en las zonas costeras son hipótesis que se relacionan con la aparición de FAN (Harrison y col., 2012; Davidson y col., 2014). Los FAN han existido desde hace mucho tiempo, por lo que es claro que los procesos de eutrofización causados por el ser humano no son un prerequisito para que estos eventos sucedan, lo que sí puede ocurrir es que aumenta la frecuencia de estos eventos y/o que estos sucedan en lugares donde antes no aparecían (Gowen y col., 2012).
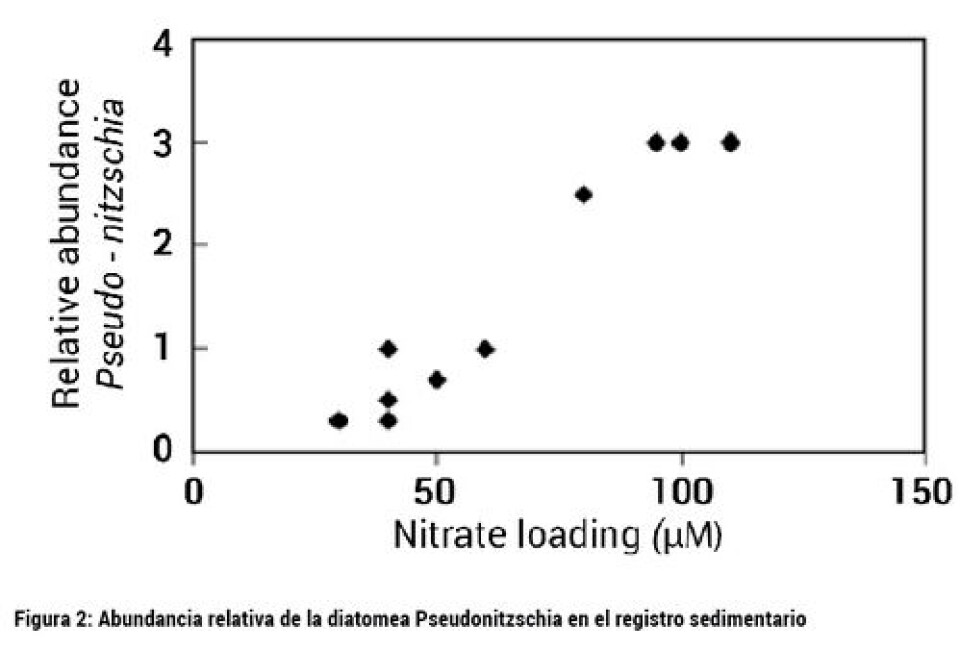
Varios investigadores (Davidson, 2011; Buschmann y col., 2005) han reportado un aparente incremento global de los FAN en aguas costeras y marinas. Si a esto unimos el incremento en la demanda de los productos del mar como moluscos filtradores que se ha producido en las últimas décadas, las FAN tienen una real importancia a nivel de la salud mundial y un importante efecto económico y social. El balance de los nutrientes intra y extracelular es crucial en el crecimiento del fitoplancton, por lo que la relación de nutrientes (radio de Redfield) es determinante en la formación de floramientos y ha sido central en las discusiones de competencia por recursos. Redfield demostró que la composición química del plancton tiende a una proporción atómica de C:N:P de 106:16:1 y el nutriente que se encuentra en menor proporción es el limitante en el crecimiento del fitoplancton (Davidson y col., 2014). Razones de <16:1 y >16:1 indican limitación por N y P respectivamente. Cambios causados por el hombre en esta relación más que en las concentraciones absolutas, se han relacionado con FAN. La relación de nutrientes también ha sugerido la influencia de producción de toxinas por algunas especies formadoras de FAN. Experimentos han demostrado elevada toxicidad cuando los nutrientes son limitantes para Pseudonitzchia (Pan y col., 1996; Wells y col., 2005, Fig. 2) y Alexandrium (John & Flynn, 2002, Murata y col., 2006), responsables de veneno amnésico y paralizante, respectivamente. como una función del nitrato en el golfo de México. Tomado de Parsons y col., (2002)
FAN en Chile En las regiones del sur de Chile, durante las últimas décadas se han detectado niveles tóxicos de veneno paralizante de marisco (VPM) y veneno diarreico de marisco (VDM) siendo Alexandrium catenella (Fig. 3) y Dinophysis acuta, las principales especies tóxicas de dinoflagelados involucradas (Uribe y col., 1999), a lo que se suma el ácido domoico, causante del veneno amnésico del los mariscos (VAM) que ha sido detectado en las regiones de Atacama y de Coquimbo a partir de 1997 y se ha asociado con las floraciones de Pseudonitzschia spp. Estas floraciones de algas nocivas en Chile, tanto de origen natural como antropogénico, están siendo monitoreadas intensivamente, aplicando métodos de detección temprana y modelos predictivos tanto por el gobierno, como por instituciones privadas. Buschmann y Fortt (2005), describieron altos valores de nitrógeno para Chiloé interior, los que además aumentan en las cercanías de las balsas jaulas de salmónidos, planteando la necesidad de establecer una relación entre las fuentes antropogénicas de nitrógeno y los actuales FAN, destacándose tres elementos que deben ser estudiados para establecer la importancia relativa del origen del nitrógeno producido por el hombre: asentamientos urbanos, transporte por erosión de nutrientes potenciado por procesos de deforestación y agricultura y, por último, el uso de fertilizantes. Buschman y Fortt (2005) hacen diferencia entre nutrientes inorgánicos y orgánicos presentes en la columna de agua de los canales del sur de Chile, donde la concentración de amonio (producto metabólico de salmones) puede variar entre los 0,002 y 0,010 mg/L, en tanto, donde existe acuicultura de mitílidos y salmónidos la concentración de amonio varía entre 0,015 y 0,026 mg/L. En lugares prístinos, las concentraciones de amonio varían desde lo no detectable hasta 0,01 mg/L.
Cultivos multitróficos Desde otro punto de vista, la posibilidad que cierto tipo de algas pueda utilizar los nutrientes liberados desde los centros de cultivo en el sur de Chile, abre la puerta a cultivos integrados o cultivos multitróficos donde los desechos de un tipo de cultivo son aprovechados por otro cultivo, disminuyendo el impacto ambiental negativo que podrían causar los cultivos por separado. Estudios han mostrado que ciertas macroalgas pueden capturar nutrientes liberados por procesos de la salmonicultura en el sur de Chile (Troell y col., 1997) y moluscos filtradores pueden aprovechar material orgánico particulado de salmones (Buschmann y col., 2001). Más aún, Vergara (2001), ha determinado que la abundancia de ciertos dinoflagelados puede aumentar en pulsos cuando se encuentran cercanos a balsas-jaulas de salmones. Tang y Glober (2011), han realizado experimentos donde el cultivo de la macroalga verde Ulva lactuca inhibe, mediante alelopatía, el crecimiento de siete especies de algas formadoras de floraciones nocivas, lo que puede funcionar como cultivo multitrófico, a la vez que actúa inhibiendo la formación de floraciones de algas que pueden ser tóxicas y causar problemas a la salud humana y a los servicios ecosistémicos de la región.
FAN y cultivos de salmónidos En Chile, las FAN han afectado la industria salmonicultora desde 1983, debido a un evento generado por dinoflagelados. No obstante, el más emblemático fue el llamado “marea café”, causado por el flagelado Heterosigma akashiwo y que provocó mortalidades importantes en el mar interior de la Región de Los Lagos, en la incipiente industria de cultivo de salmones. Posteriormente, se han registrado otros eventos nocivos provocados por las diatomeas Leptocylindrus minimus (Clément, 1994), L. danicus, Chaetoceros convolutus (Clément y Lembeye, 1993), Rhizozolenia setigera, y los dinoflagelados Alexandrium catenella y Gymnodinium sp. (Clément y col., 1999). A éstos se suma la rafidoficea Chatonella sp, que se observó el 2004 en Chiloé, provocando irregularidades en los salmónidos (SalmonChile, 2008). En diciembre del 2014, cuatro empresas salmonicultoras fueron afectadas, ésta vez, en dos focos de floraciones de microalgas, que provocaron altas mortalidades de peces y se produjeron en forma simultánea en la zona norte de Aysén y en Magallanes, en el sector de Última Esperanza. En total habrían significado pérdidas cercanas a los 400 mil peces, de unos 2,5 kg cada uno. Las pérdidas económicas alcanzaron los US$ 10 a US$ 12 millones, sólo en la Región de Magallanes. Si observamos el panorama de la salmonicultura y la acuicultura en general en el sur de Chile, la gran densidad de los centros de cultivo especialmente en las regiones de Los Lagos y Aysén y se plantea la hipótesis que la gran cantidad de nutrientes (N, P, Amonio, urea, carbono orgánico particulado y disuelto) liberados al medio ambiente debido a la acuicultura, pueden haber provocado en reiteradas ocasiones floraciones de algas nocivas, se hace imperativo realizar más estudios para establecer con mayor claridad las causas y los efectos de estas floraciones algales y su relación con la acuicultura en Chile. Según Buschmann y col., (2007), en la mayoría de lugares en Chile no se han registrado aumentos detectables en la concentración de nitrógeno en la columna de agua cerca de las balsas jaulas de salmón, con la excepción de las zonas que presentan mayor densidad de peces cultivados. Llegaron a la conclusión de que, mientras que el exceso de nitrógeno inorgánico de las jaulas de salmón está disponible para el fitopláncton, las variables hidrodinámicas de los sectores de emplazamiento son los determinantes más importantes del impacto real y sólo los sitios con baja energía exhibirán un aumento de la biomasa de fitoplancton a nivel local. También concluyeron que hay poca evidencia científica, fuera de los limitados estudios de laboratorio y un informe de campo en Chile, de que la carga de nutrientes del cultivo de salmón es suficiente para iniciar y sostener las floraciones de algas nocivas. Más recientemente, Niklitschek y col., (2013), a pesar del hecho de que los fiordos patagónicos son relativamente pobres en nutrientes, han descrito que los enormes volúmenes de N y P liberados de los centros de cultivo no han proporcionado pruebas de enriquecimiento de nutrientes medibles y/o cambios detectables en los ecosistemas pelágicos en aguas circundantes. Sin embargo, otro estudio reciente (Iriarte y col., 2013) ponen de manifiesto la complejidad de la dinámica de nutrientes de la región patagónica y el desafío de la atribución de causas y efectos debidos a la acuicultura del salmón. Concluyen que la dinámica de las floraciones de fitoplancton, incluyendo las de las FAN, a pesar de su gran impacto en la salud de la acuicultura y el medio ambiente, siguen siendo una pregunta sin respuesta y un desafío importante de investigación en las aguas costeras del ecosistema marino patagónico. Finalmente Niklitschek y col., (2013) concluyen que el riesgo de exceder la capacidad del ecosistema para incorporar nutrientes en la capacidad de carga de la red alimentaria es un asunto de preocupación inmediata. Estos autores señalan que no hay estudios disponibles de capacidad de carga para la zonas australes, y la investigación científica limitada es un gran obstáculo para la reducción de los riesgos ambientales en el proceso de expansión de la industria salmonicultora.
Bibliografía Bruno, D. Dear, G. & D. Seaton. 1989. Mortality associated with phytoplankton blooms amongst farmed Atlantic Salmon, Salmo salar. L. in Scotland. Aquaculture, 217-222. Buschmann A, D López, ML González, L Filún, G Aroca & M Cifuentes 2001. Manejo Sustentable de los recursos marinos bentónicos en Chile Centro Sur. Sub proyecto policultivos. Síntesis Histórica y Logros Académicos. (Eds. Faranda, R Frache, R Albertini y JA Correa) Pontificia Universdad Católica de Chile. 335 pp. Buschmann AH & A. Fortt. 2005. Efectos ambientales de la acuicultura intensiva y las alternativas para un desarrollo sustentable. Ambiente y Desarrollo. Buschmann, A., B. A. Costa-Pierce, S. Cross, J. L. Iriarte, Y. Olsen, and G. Reid. 2007. Nutrient Impacts Of Farmed Atlantic Salmon (Salmo Salar) On Pelagic Ecosystems And Implications For Carrying Capacity. Salmon Aquaculture Dialogue, WWF. Davidson, K. Gowen, R. Harrison, P. Fleming, L. Hoagland, P. & G. Moschonas. 2014. Anthropogenic nutrients and harmful algae in coastal waters. Journal of Environmental Management 146 (2014) 206-216. Davidson, K. Tett, P. & R. Gowen. 2011. Harmful algal blooms. In: Hester, R. Harrison, R. (Eds.), Marine Pollution and Human Health, pp. 95-127. Clément A & Lembeye G. 1993. Phytoplankton Monitoring Program in the Fish Farming Region of South Chile. IN: Smayda, T. & Y. Shimizu (Eds.), Toxic Phytoplankton Blooms in the Sea, pp. 223-228, Elsevier Science Publishers B.V. Clément A. 1994. Harmful blooms of Leptocylindrus minimus in Southern Chile. Harmful Algae News, 8: 1. Clément A, Seguel M & Arzul G. 1999. Fish kill in Chile associated with bloom of Gymnodinium sp. HAB N°19: pp. 5-6. Ferreira, J.G. Andersen, J.H. Borja, A. Bricker, S.B. Camp, J. Cardoso da Silva, M. Garce s, E. Heiskanen, A.-S. Humborg, C. Ignatiades, L. Lancelot, C. Menesguen, A. Tett, P. Hoepffner, N. & U. Claussen. 2011. Overview of eutrophication indicators to assess environmental status within the European Marine Strategy Framework Directive. Estuar. Coast. Shelf Sci. 93, 117-131. Gowen, R.J. Mckinney, A. Tett, P. Bresnan, E. Davidson, K. Harrison, P.J. Milligan, S. Mills, D.K. Silke, J. & A. M. Crooks. 2012. Anthropogenic nutrient enrichment and blooms of harmful phytoplankton. Oceanogr. Mar. Biol. 50, 65-126. Guildford, S. & R. Hecky. 2000. Total nitrogen, total phosphorus, and nutrient limitation in lakes and oceans: is there a common relationship? Limnology and Oceanography 45, 1213–1223. Harrison, P.J. Xu, J. Yin, K. Liu, H. Lee, J. Anderson, D. & I. Hodgkiss. 2012. Is there a link between N:P ratios and red tides in Tolo Harbour, Hong Kong? In: Pagou, K. Hallegraeff, G. (Eds.), Proceedings of 14th International Conference on Harmful Algae, Hersonissos-Crete, Greece, pp. 90-92. Iriarte JL1, Pantoja S, González HE, Silva G, Paves H, Labbé P, Rebolledo L, Van Ardelan M, Häussermann V. 2013. “Assessing the micro-phytoplankton response to nitrate in Comau Fjord (42°S) in Patagonia (Chile), using a microcosms approach.” Environmental monitoring and assessment 185(6): 50555070. John, E. & K. Flynn. 2002. Modelling changes in paralytic shellfish toxin content of dinoflagellates in response to nitrogen and phosphorus supply. Mar. Ecol., Prog. Ser. 225, 147-160. Niklitschek, E. J., D. Soto et al. 2013. “Southward expansion of the Chilean salmon industry in the Patagonian fjords: main environmental challenges.” Reviews in Aquaculture 5(3): 172195. Murata, A. Leong, S.C.Y. Nagashima, Y. & S. Taguchi. 2006. Nitrogen:Phosphorus supply ratio may control the protein and total toxin of dinoflagellate Alexandrium tamarense. Toxicon 48, 683-689. Paerl, H. 2006. Assessing and managing nutrient-enhanced eutrophication in estuarine and coastal waters: Interactive effects of human and climatic perturbations. Ecological Engineering 26 (2006) 40–54. Pan, Y. Subba Rao, D. Mann, K.H. RG, B. & R. Pocklington. 1996. Effects of silicate limitation on production of domoic acid, a neurotoxin, by the diatom Pseudonitzschia multiseries. I. Batch Cult. Stud. Mar. 131, 225-233. Parsons, M.L. Dortch, Q. & R.E. Turner. 2002. Sedimentological evidence of an increase in Pseudo-nitzschia (Bacillariophyceae) abundance in response to coastal eutrophication. Limnol. Oceanogr. 47, 551–558. SalmonChile 2008. Ocurrencia e impacto de Floraciones Algales Nocivas en la Salmonicultura en el sur de Chile. Compendio Nº 6, Área Medio Ambiente, Intesal de SalmonChile. Período: 1992-2006 Sournia, A. 1995. Red tide and toxic marine phytoplankton of the world ocean: an inquiry into biodiversity, in: Harmful Marine Algal Blooms. Proceedings of the 6th International Conference on Toxic Marine Phytoplankton October 1993, Nantes, France. pp. 103-112. Troell M, C Halling, A Nilsson, A Buschmann, N Kautsky & l Kautsky 1997. Integrated marine cultivation of Gracilaria chilensis (Gracilariales, Rhodophyta) and salmon cages for reduced environmental impact and increased economic out put . Aquaculture 156:45-61. Uribe, P, BA Suárez-Isla & RT Espejo 1999. Ribosomal RNA heterogenrity and identification of toxic dinoflagellate cultures by heteroduplex mobility assay. J. Phycol 35 (4) : 884-888. Vergara, P.A. (2001). Efectos ambientales de la salmonicultura: el caso de Bahía Metri, Chile. Tesis de Grado de Magister, Universidad de Los Lagos, Osorno, 188 pp. Wells, M.L. Trick, C.G. Cochlan, W.P. Hughes, M.P. &V. L. Trainer. 2005. Domoic acid: the synergy of iron, copper, and the toxicity of diatoms. Limnol. Oceanogr. 50, 1908-1917. Ying Li, Wenzhi Cao, Caixia Su & Huasheng Hong, 2011, Nutrient sources and composition of recent algal blooms and eutrophication in the northern Jiulong River, Southeast China. Marine Pollution Bulletin 63 (2011) 249–254.




















