Incremento de la tasa de retención (depósito) de astaxantina en salmónidos
Jorge Escobar Fica1, Miguel Ríos Ramirez2, Jaime Carrasco Candía3.1, Pontificia Universidad Católica de Valparaíso; 2, Universidad de Santiago de Chile;3, Biomar Chile.
En la industria del salmón, los costos más significativos están asociados a la alimentación. Los pigmentos incorporados en la dieta son parte de los costos asociados a la alimentación. En la práctica, uno de los principales criterios de calidad está dado por el color de la musculatura (filete). Por esta razón, en nuestro país, la industria del salmón invierte grandes sumas de dinero en pigmentos. Sin embargo, los pigmentos son asimilados con muy poca eficiencia. De la cantidad total de colorantes incorporados en la dieta, más de la mitad es eliminado directamente por el tracto digestivo, sin ser asimilado y del porcentaje que logra ser asimilado, una fracción importante es metabolizado y posteriormente eliminado. La especie que mejor retiene la astaxantina en la musculatura es la trucha arcoíris (20-22 mg/Kg), seguida por el salmón Coho (16-18 mg/kg) y por último el salmón Atlántico, que sólo retiene de 8 a 10 mg/Kg. Si pensamos, además, que el mayor porcentaje del salmón Coho se exporta por vía marítima, donde el producto se transporta congelado, se presentan problemas adicionales con la estabilidad del pigmento, ya que por lo general, a partir de los 30 días se produce una caída constante del color, con la consiguiente pérdida de valor del producto. En este contexto Biomar chile, junto a la Pontificia Universidad Católica de Valparaíso y la Universidad de Santiago de chile, han desarrollado un aditivo nutricional, denominado CompG, que entre otras cosas incrementa considerablemente la tasa de retención de astaxantina en salmónidos, potenciando la expresión de color y disminuyendo eficientemente la pérdida de color durante el almacenamiento de productos congelados. El CompG apunta fundamentalmente a proteger la astaxantina ya absorbida y que se encuentra a nivel sistémico (lipoproteínas), así como también, la depositada en la musculatura y estructuras lipídicas. La absorción de astaxantina en el intestino de salmonideos ocurre por difusión simple y es concomitante con la asimilación de los lípidos de la dieta. Se asume que el pigmento estaría asociado a micelas, junto a las sales biliares, ácidos grasos, monoacilglicéridos (MAGs) y otras vitaminas hidrofóbicas como la vitamina A, ácido retinoico etc. La asimilación es un proceso que ocurre en forma lenta y toma entre 18 y 30 horas, dependiendo de la composición y formulación de la dieta. Los ácidos grasos libres son esterificados para generar triacilglicéridos (TAGs), los cuales junto a la astaxantina son incorporados a los quilomicrones. No obstante esto, a nivel plasmático, se observa una alta proporción de astaxantina circulante asociada a seroalbúmina. En este contexto, se sabe que la seroalbúmina se asocia a la superficie de los quilomicrones adquiriendo el pigmento directamente desde estos. Este hecho, refleja la alta afinidad de la seroalbúmina por la astaxantina. En este mismo sentido, se sabe también que la seroalbúmina se asocia con alta afinidad a los ácidos grasos y a la astaxantina liberada, por acción de la enzima lipoproteinlipasa a nivel endotelial, durante la lipolisis de los quilomicrones. La astaxantina, distribuida de esta forma a nivel sistémico, no sufre modificaciones que alteren sus propiedades pigmentantes y una vez depositada en la musculatura, permanece estable por largos periodos. En la práctica, la capacidad de la musculatura para fijar el colorante es saturable, pero si, en condiciones experimentales (condiciones absolutamente controladas), al pez se le suspende el suministro de pigmentos por periodos superiores a los tres meses, éste es capaz de retener más del 95% del contenido de astaxantina en su musculatura. Esto no sucede en condiciones intensivas de cultivo, donde el pigmento es oxidado o eventualmente removido, desde la musculatura, en forma mucho más rápida, lo que explica la rápida perdida de color en la musculatura, al disminuir el contenido de astaxantina en la dieta.
Principales vías de pérdidas sistémicas de astaxantina La remoción del pigmento desde la musculatura puede ocurrir bajo las siguientes condiciones: 1. Por acción hormonal: en peces sexualmente maduros, comienza la degradación autolítica de la musculatura. En peces inmaduros sexualmente, la musculatura es el depósito natural del pigmento donde se conserva en muy buenas condiciones por largos periodos. 2. Por metabolización del pigmento: Los carotenos son mayoritariamente metabolizados en el hígado. En este órgano parte de los carotenos son utilizados como precursores para la biosíntesis de vitamina A y el exceso es modificado generando metabolitos no pigmentante. Finalmente, estos son excretado en a la secreción biliar. Las vías metabólicas específicas que hacen posible la degradación y excreción de los carotenos a nivel hepático no están del todo aclaradas, sin embargo, se ha establecido que la astaxantina no metabolizada en el hígado es reincorporada en lipoproteínas de baja densidad (VLDL) antes de ser enviadas a la circulación sistémica. La capacidad del hígado para catabolizar la astaxantina es saturable sólo a dosis muy elevadas, lo que convierte a este órgano en el principal responsable de las pérdidas metabólicas de astaxantina. No obstante esto, el suministro de cantidades suficientes de Vitamina A en la dieta, como para satisfacer ampliamente los requerimientos fisiológicos de esta Vitamina, reduce considerablemente las pérdidas metabólicas del pigmento. A nivel renal, sólo se ha observado la excreción marginal de astaxantina y de algunos productos de degradación hepática. En el intestino en cambio, se ha observado una activa metabolización de la astaxantina hacia la formación de vitamina A, la cual -al igual de lo que sucede con la metabolización hepática del pigmento- se ve fuertemente reducida, con la administración exógena de Vitamina A (en la dieta). 3. Por desbalance oxidativo: el incremento de especies reactivas del oxígeno (ROS) reaccionan preferentemente con la astaxantina, dado que este pigmento tiene una capacidad antioxidante mayor que la vitamina E (500 veces más). En este contexto se debe considerar que los lípidos de membrana son extremadamente sensibles a la peroxidación, lo que requiere un control permanente de los sistemas antioxidantes enzimáticos (glutatión peroxidasa, GPx) y no enzimáticos (Vitamina E) en el control de especies radicalarias. El rápido crecimiento muscular, por la mayor demanda tisular de oxígeno (fase de engorda), el daño hepático (dietas extremadamente calóricas), el estrés asociado a condiciones de cultivo intensivo (alta densidad de peces) eleva considerablemente los niveles de ROS, los cuales consumen rápidamente la astaxantina asociada a las estructuras lipofílicas, dado que, como se mencionó anteriormente, este pigmento tiene aproximadamente 500 veces más capacidad antioxidante que la Vitamina E. Este fenómeno, dependiendo de la magnitud del desbalance oxidativo, puede provocar importantes pérdidas de pigmento en la musculatura y una caída considerable del color de los filetes al momento de la cosecha. En el contexto anterior, desde el punto de vista productivo, el primer punto no reviste importancia, dado que los peces son cosechados antes de alcanzar la madurez sexual. El segundo punto es manejable (metabolización hepática), administrando cantidades suficientes de Vitamina A en la dieta de los peces. El tercer punto en cambio es de la mayor importancia, por cuanto en la práctica es extremadamente difícil, sino imposible, cultivar peces intensivamente sin estrés. En esta dirección, el principal blanco de las especies reactivas del oxígeno lo constituyen los lípidos. Estas bio-moléculas son las que sufren el mayor daño, dado que se peroxidan fácilmente y además, los lipoperóxidos por reacción en cadena, dañan extensivamente las membranas. Esto es especialmente grave en peces, dado que poseen naturalmente tejidos ricos en ácidos grasos omega-3 de cadena larga altamente insaturados (PUFA). Estos ácidos grasos (PUFA) se peroxidan con extrema facilidad. Por esta razón los requerimientos de antioxidantes liposolubles como la Vitamina E y pigmentos como la astaxantina son de suma importancia en el cultivo de salmónidos, para la adecuada mantención de los tejidos y lograr un contenido aceptable de PUFA, en el producto final.
Principales fuentes de generación de ROS La oxidación de lípidos es iniciada por radicales libres. La formación de radicales se encuentra asociada a procesos fisiológicos normales, tales como: 1. Explosión respiratoria: la explosión respiratoria asociada a neutrófilos y fagocitos que al ser estimulados por algún agente patógeno generan importantes cantidades de ión superóxido para destruir el patógeno. Este es un fenómeno localizado, que ocurre solo en el lugar donde se encuentra el patógeno, salvo en el caso extremo de una septicemia donde los ROS se pueden distribuir en forma sistémica. 2. Cadena respiratoria: durante la respiración celular también se generan importantes cantidades de ión superóxido (reducción monovalente del O2). En este contexto, se debe tener en cuenta que el funcionamiento basal de la cadena respiratoria puede ser fuertemente modificada por numerosos factores tales como, rápido crecimiento celular (fase de engorda), la actividad física intensa, las reacciones de agresividad, en general el estrés, condición bajo la cual incrementan los niveles de cortisol. Esta hormona estimula el catabolismo, acelerando el funcionamiento de la cadena respiratoria, con el consiguiente incremento de los niveles del ión superóxido (ROS) 3. Detoxificación de xenobióticos: la detoxificación de xenobióticos en peroxisomas y retículo endoplásmico liso (citocromo p450) y procesos degenerativos, especialmente hepáticos, ocasionados por una ingesta excesiva de lípidos (dietas hipercalóricas, diseñadas para un rápido crecimiento de salmónidos) o por la ingesta de aceites con elevado índice de peróxidos, produce a nivel sistémico un desbalance oxidativo que fácilmente puede superar los mecanismos antioxidantes enzimáticos, lo cual finalmente redunda en una drástica reducción de los contenidos tisulares de antioxidantes no enzimáticos, tales como Vitamina C, Vitamina E, Glutatión reducido (GSH) y beta-carotenos como la astaxantina. Este es un punto especialmente importante, dada la extrema facilidad de los ácidos grasos omega-3 de cadena larga (PUFA) para sufrir peroxidación. En la práctica, durante el periodo de almacenaje del aceite de pescado, el cual tiene un contenido de PUFA cercano al 30%w/w, es muy difícil evitar que este insumo no sufra un cierto grado de peroxidación. Estos peróxidos al ingresar a nivel sistémico, por reacción en cadena, provocan un daño extensivo de las estructuras lipídicas, especialmente de las membranas celulares. La neutralización de estos radicales, puede llegar a agotar los antioxidantes tisulares mencionados anteriormente, lo que impactará negativamente sobre la pigmentación de la musculatura, dado que la capacidad antioxidante de la astaxantina es mucho mayor que la capacidad antioxidante de la vitamina E, de tal forma, que los peróxidos reaccionarán preferentemente con el pigmento, destruyendo sus propiedades pigmentantes y en segundo lugar con la vitamina E. 4. Oxidación no catalítica de la oxihemoglobina: una cantidad importante de radicales superóxido se produce también, por la oxidación no catalítica de la oxihemoglobina, en cuyo proceso alrededor de un 3% se oxida diariamente a metahemoglobina
Defensas antioxidantes Dado el constante riesgo de exposición, de las estructuras celulares, a especies reactivas del oxígeno, los sistemas biológicos han desarrollado un sistema de defensa antioxidante, el cual incluye un poderoso sistema enzimático, capaz de inactivar eficientemente diversas especies radicalarias, así como también de un sistema no enzimático, antioxidantes tales como el Glutatión reducido (GSH), la Vitamina E (alfa-tocoferol; liposoluble) y la Vitamina C (ácido ascórbico; hidrosoluble). En este contexto hacemos especial énfasis en el GSH, las enzimas glutatión peroxidasa (GPx) y Glutatión reductasa. Estos elementos, en conjunto con las enzimas superóxido dismutasa (SOD), constituyen el principal sistema de defensa antioxidante que protege lípidos y membranas. La figura N°1, describe una de las principales fuentes generadora de especies reactivas del oxígeno, que corresponde a la reducción monovalente del O2 asociada a la respiración celular (otras fuentes generadoras de radicales se describen en el punto anterior). Este radical, de inmediato es transformado en peróxido de hidrógeno. Este último, aun cuando es extremadamente reactivo, es relativamente estable y puede difundir hasta alcanzar las membranas, donde puede fácilmente generar radicales hidroxilos (OH-) que destruyen la membrana. El exceso de estos radicales es atrapado por moléculas antioxidantes, específicamente por la vitamina E, que por su naturaleza hidrofóbica se encuentra asociada preferentemente a estructuras lipofílicas. La astaxantina, que también es fuertemente hidrofóbica, se encuentra en los mismos compartimientos celulares que la vitamina E. Como se puede apreciar en la figura N°1, el peróxido de hidrógeno es eliminado por dos enzimas, la catalasa y la GPx. Ambas enzimas, son las responsables de controlar los niveles sistémicos de peróxidos. La GPx utiliza glutatión para inactivar los peróxidos y como cofactor utiliza Selenio. Por esta razón la incorporación exógena de precursores de GSH, que incrementan los niveles sistémicos de GSH (glutatión reducido), más selenio orgánico, que aporta el cofactor de la enzima, incrementa considerablemente la efectividad de la GPx en el proceso de inactivación de peróxidos, reduciendo eficientemente la generación de especies radicalarias. Además, el glutatión es un metabolito involucrado en la detoxificación de xenobióticos y al igual que el selenio, es también un potente protector hepático. Estas funciones del glutatión, lo convierten en el metabolito más importante en el control de procesos que generan estrés oxidativo. Por esta razón, aun cuando la capacidad antioxidante del glutatión es mucho menor que la capacidad antioxidante de la astaxantina, el incremento a nivel sistémico de glutatión reducido (de la razón GSH/GSSG) evita que especies radicalarias modifiquen químicamente el pigmento, porque en la práctica disminuye la tasa de generación de ROS. El CompG, administrado en el alimento de salmónidos, como un aditivo nutricional, incrementa establemente los niveles plasmáticos de glutatión, en una proporción variable, que depende en gran medida del grado de estrés oxidativo al que estén sometidos inicialmente los peces. Sin embargo, en la práctica, normalmente se observa un incremento de GSH y de la relación GSH/GSSG que se aproxima al ejemplificado en la figura N°2. La administración de CompG produce un incremento de los niveles plasmáticos de GSH y de la relación GSH/GSSG, lo que produce un considerable incremento de la capacidad antioxidante sistémica de los peces.
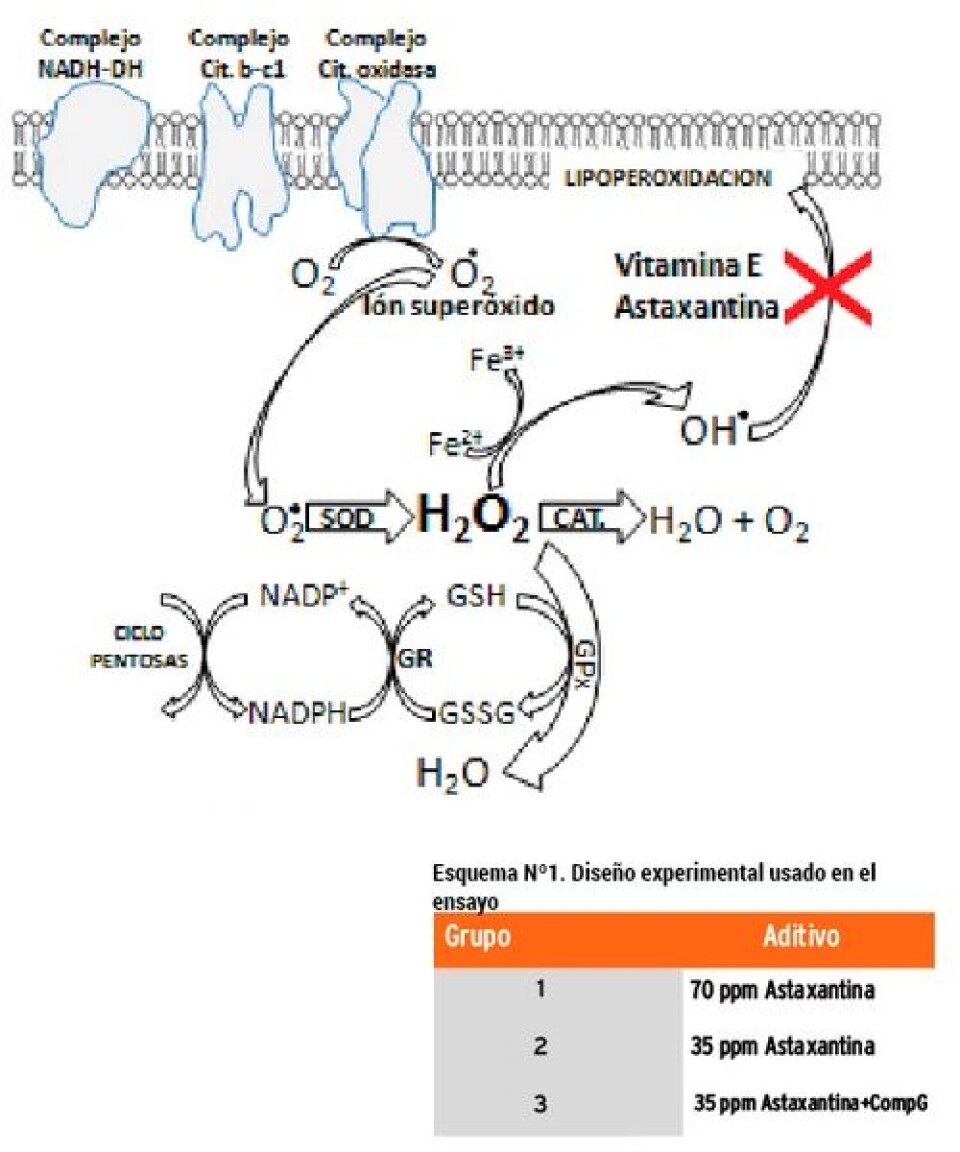
Modelo experimental Se distribuyeron al azar 270 ejemplares de Salmo salar de 640,5 gr de peso promedio en 9 estanques de 7 m3 a razón de 30 individuos por estanque. Se constituyeron 3 grupos de 3 estanques cada uno, de acuerdo con el esquema nº1. Todos los grupos se alimentaron con dieta comercial a la cual alimentaron a saciedad en forma manual con 4 a 5 raciones diarias. La temperatura promedio fue de 10,5°C. (Rango 8,2 – 13,0 °C). Mensualmente se midió peso y talla de cada uno de los individuos en todos los estanques. Una vez finalizada la etapa de cultivo, todos los peces fueron sacrificados (con un peso promedio de 1.632 gramos) con metodología similar a la empleada en cosechas comerciales, esto es desangrado en agua hielo por corte de branquias.
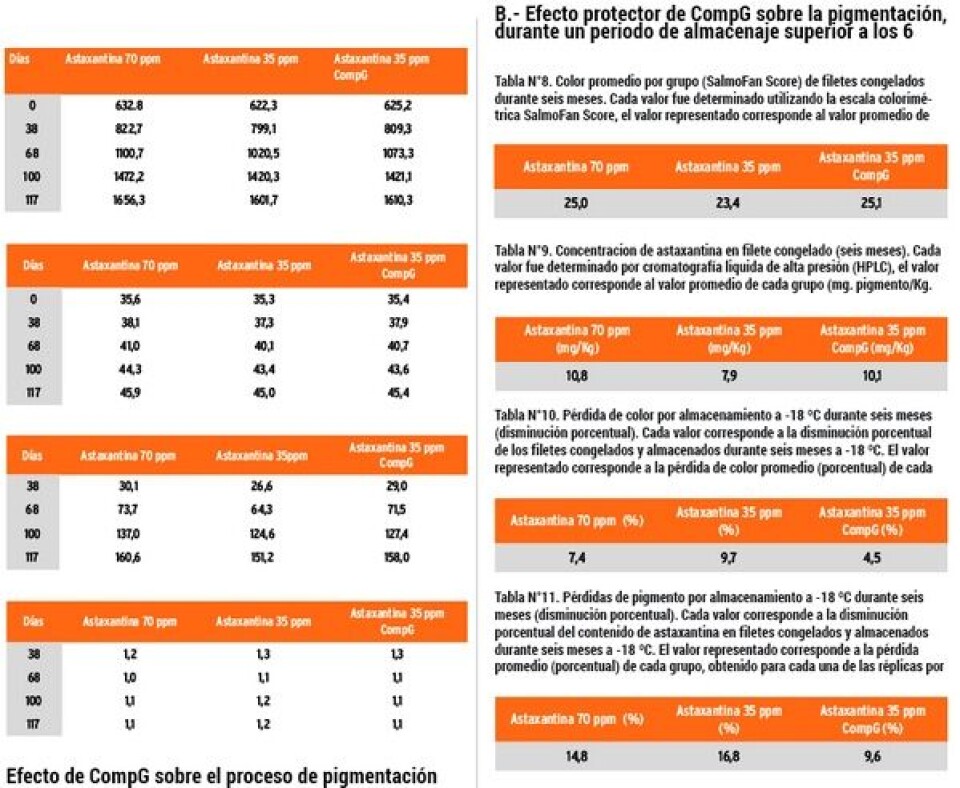
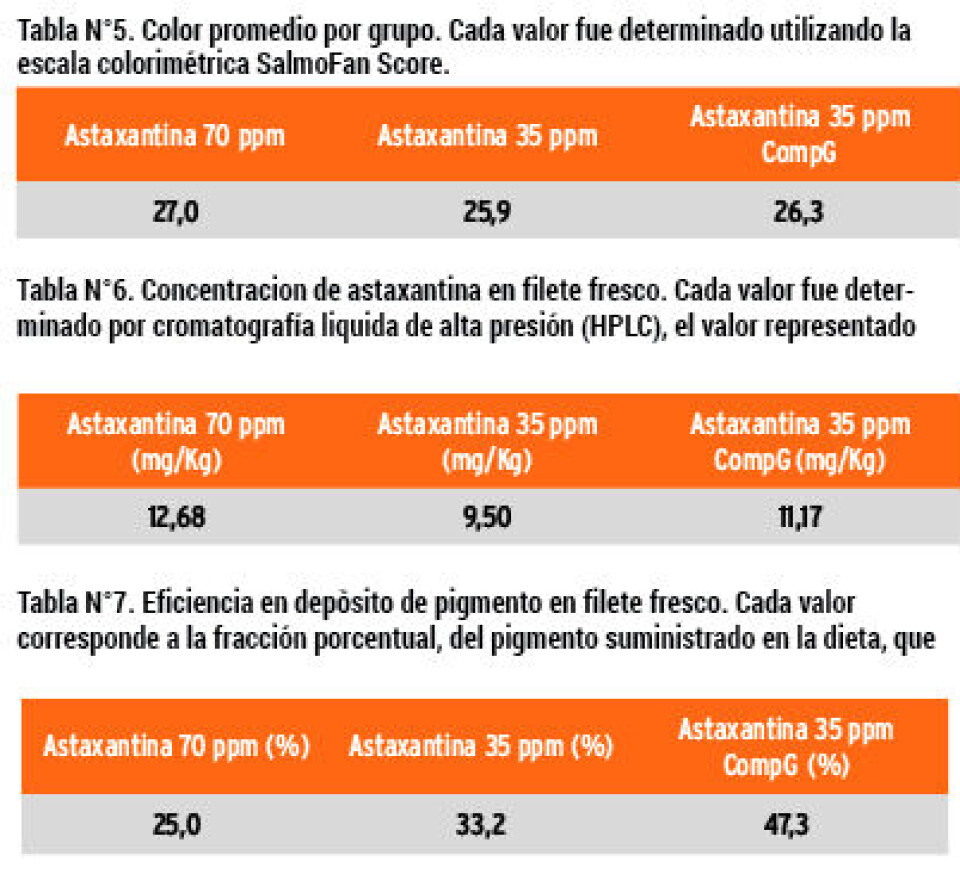
Resultados Se proporciona un resumen de los parámetros productivos más relevantes, tabulados de tal forma que se pueda comparar directamente el efecto de CompG con el grupo control.




















